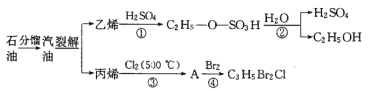
题目内容
【题目】下列说法正确的是( )
A.相同条件下,测得![]() 溶液的pH大于相同物质的量浓度的
溶液的pH大于相同物质的量浓度的![]() 溶液,说明非金属性:
溶液,说明非金属性:![]()
B.绝热容器中,向50mL1![]() 的盐酸中加入烧碱,水的
的盐酸中加入烧碱,水的![]() 不变
不变
C.相同温度时,![]() 分别在相同物质的量浓度的
分别在相同物质的量浓度的![]() 溶液和
溶液和![]() 溶液中的溶解度相同
溶液中的溶解度相同
D.有HX和HY两种弱酸且酸性![]() ,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有
,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有![]()
【答案】D
【解析】
![]() 相同条件下,测得
相同条件下,测得![]() 溶液的pH大于相同物质的量浓度的
溶液的pH大于相同物质的量浓度的![]() 溶液,说明碳酸根水解程度比亚硫酸根水解程度大,根据越弱越水解可知,碳酸酸性小于亚硫酸,但亚硫酸不是最高价含氧酸,不能比较非金属性,故A错误;
溶液,说明碳酸根水解程度比亚硫酸根水解程度大,根据越弱越水解可知,碳酸酸性小于亚硫酸,但亚硫酸不是最高价含氧酸,不能比较非金属性,故A错误;
B. Kw只受温度的影响,盐酸中加入烧碱发生酸碱中和反应,放出热量,使体系温度升高,Kw值增大,故B错误;
C. 相同物质的量浓度的![]() 溶液和
溶液和![]() 溶液中,硫酸铝溶液中硫酸根离子浓度大,
溶液中,硫酸铝溶液中硫酸根离子浓度大,![]() ,平衡逆向进行程度大,则硫酸钡在硫酸铝溶液中溶解度小,故C错误;
,平衡逆向进行程度大,则硫酸钡在硫酸铝溶液中溶解度小,故C错误;
D. 因为酸性![]() ,所以水解能力
,所以水解能力![]() ,则体积和浓度相同的NaX和NaY溶液混合后离子浓度关系为:
,则体积和浓度相同的NaX和NaY溶液混合后离子浓度关系为:![]() ,故D正确;
,故D正确;
故选D。

练习册系列答案
相关题目