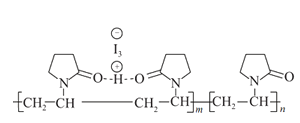
题目内容
【题目】类比推理是化学中常用的思维方法。下列推理正确的是![]()
A.HF是卤族元素的氢化物中沸点最高的,因为HF分子间存在氢键,所以![]() 也是同族元素氢化物中沸点最高的
也是同族元素氢化物中沸点最高的
B.NaCl与浓硫酸加热可制得HCl,推测NaI与浓硫酸加热可制得HI
C.因为AgCl、AgBr、AgI均难溶,推测AgF也难溶于水
D.由于还原性![]() ,推测还原性
,推测还原性![]()
【答案】D
【解析】
![]() 虽然氨气分子间存在氢键,但是氨气不是氮族元素中沸点最高的氢化物,故A错误;
虽然氨气分子间存在氢键,但是氨气不是氮族元素中沸点最高的氢化物,故A错误;
B. 浓硫酸能氧化碘离子生成碘,所以NaI和浓硫酸共热不能得到HI,故B错误;
C. 虽然AgCl、AgBr、AgI都难溶于水,但是AgF是可溶性银盐,故C错误;
D. 同一主族元素,其氢化物的还原性随着原子序数增大而增强,原子序数![]() 、
、![]() ,所以氢化物的还原性
,所以氢化物的还原性![]() 、
、![]() ,故D正确;
,故D正确;
故选D。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1mol H2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式________ 。
(2)已知:乙苯催化脱氢制苯乙烯反应:苯在计算键能时,此处可看作为![]() ,
, ![]()
![]()
![]() +H2(g)
+H2(g)
化学键 | C—H | C—C | C=C | H—H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的ΔH=________ kJ·mol-1。
Ⅱ.25 ℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_______。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:________。
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g) + Y(g)![]() Z(g)。反应过程中测定的部分数据如下表:
Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A. 反应1~2min末的平均速率v(Z)=0.2mol/(L·min)
B. 在2min~4min间,v(X)正>v(Y)逆
C. 生成1mol Z的同时,生成1mol X能说明该反应已达化学平衡状态
D. 其他条件不变,再充入1.2mol X,X的转化率将增大