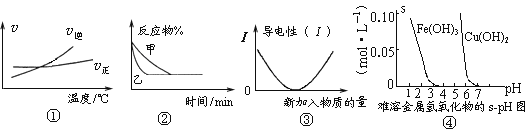
题目内容
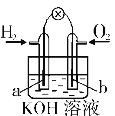
【题目】某原电池装置如右图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是

A.正极反应AgCl +e-= Ag+Cl-
B.正极反应Cl2 +2e- +2Ag+=2AgCl
C.放电时右侧盐酸的浓度变大
D.当电路中转移0.01 mol e-时,析出沉淀1.08g
【答案】C
【解析】
A. 正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e═2Cl,故A错误;
B. 正极上氯气得电子生成氯离子,而正极处没有Ag+,其电极反应为:Cl2+2e═2Cl,故B错误;
C. 放电时右侧生成Cl-,左侧的H+通过阳离子交换膜进入右侧,则右侧盐酸的浓度变大,故C正确;
D. 放电时,当电路中转移0.01mole时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成0.01mol氯化银沉淀,0.01mol×143.5g/mol≈1..44g,故D错误;
故选C。

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目