题目内容
【题目】在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
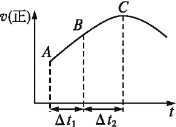
A.反应物浓度:A点小于C点
B.该反应的正反应为吸热反应
C.C点时反应进行的程度最大
D.Δt1=Δt2时,生成H2的物质的量:AB段小于BC段
【答案】D
【解析】
由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快。
A.A到C时正反应速率增加,反应物浓度随时间不断减小,所以反应物浓度:A点大于C点,故A错误;
B.从A到C正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故B错误;
C.化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,C点对应的正反应速率显然还在改变,故一定未达平衡,故C错误;
D.随着反应的进行,正反应速率越快,生成氢气的产率将逐渐增大,△t1=△t2时,H2的产率:AB段小于BC段,故D正确;
故答案为D。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】化学平衡状态Ⅰ、Ⅱ、III的相关数据如下表:
编号 | 化学方程式 | 平衡常数 | 温度 | |
979K | 1173K | |||
Ⅰ | Fe(s)+CO2(g) FeO(s)+ CO(g) | K1 | 1.47 | 2.15 |
Ⅱ | CO(g)+H2O(g) CO2(g)+H2(g) | K2 | 1.62 | b |
Ⅲ | Fe(s)+ H2O(g) FeO(s) +H2(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论正确的是
A.a<b
B.反应Ⅱ、III均为放热反应
C.升高温度平衡状态III向正反应方向移动
D.增大压强,状态Ⅱ正反应速率增大,逆反应速率减小,平衡不移动




