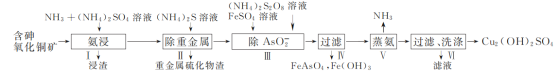
题目内容
【题目】(1)已知下列热化学方程式:
H2(g)+1/2O2(g)==H2O(l) ΔH=285.8 kJ·mol1
H2(g)+1/2O2(g)==H2O(g) ΔH=241.8 kJ·mol1
C(s)+ 1/2O2(g)==CO(g) ΔH=110.5 kJ·mol1
C(s)+O2(g)==CO2(g) ΔH=393.5 kJ·mol1
回答下列问题:
①燃烧10gH2生成液态水,放出的热量为________。
②CO的燃烧热为________。
(2)0.3mol乙硼烷气体(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________________。
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出稀H2SO4溶液与稀NaOH溶液反应的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
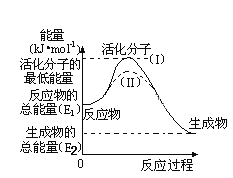
(5)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
①图中反应的ΔH=_____________kJ/mol(用含有E1、E2代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则H2O(g)=H2(g)+1/2O2(g)的活化能为________kJ/mol。
【答案】1429.0 kJ 283.0 kJ/mol B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ/mol -(E1- E2)或(E2-E1) 409
【解析】
根据盖斯定律及热化学反应方程式的书写规则分析解答。
(1) ①10gH2的物质的量为5mol,根据已知条件可知,H2(g)+1/2O2(g)==H2O(l) ΔH=285.8 kJ·mol1,可知燃烧10gH2生成液态水,放出的热量为:285.8 kJ×5= 1429.0 kJ;故答案为:1429.0 kJ;
② a.C(s)+ 1/2O2(g)==CO(g) ΔH=110.5 kJ·mol1,b.C(s)+O2(g)==CO2(g) ΔH=393.5 kJ·mol1,![]() [b-2×a]得到,CO(g) + 1/2O2(g)= CO2(g) ΔH=283.0 kJ/mol;
[b-2×a]得到,CO(g) + 1/2O2(g)= CO2(g) ΔH=283.0 kJ/mol;
故答案为:283.0 kJ/mol;
(2) 0.3mol乙硼烷气体(B2H6)在氧气中燃烧,即B2H6(g)+O2(g)==B2O3(s)+H2O(l) △H= -649.5kJ×![]() =-2165 kJ/mol;
=-2165 kJ/mol;
故答案为:B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1;
(4)根据已知条件,①2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1,②2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol–1,②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1,
2NO2(g) ΔH=-113.0 kJ·mol–1,![]() (②-①)得到,NO2(g)+SO2(g)=SO3(g)+NO(g) ΔH=
(②-①)得到,NO2(g)+SO2(g)=SO3(g)+NO(g) ΔH=![]() -113.0-(-196.6)]= -41.8kJ/mol;
-113.0-(-196.6)]= -41.8kJ/mol;
故答案为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ/mol;
(5) ①从图中可知,反应物的总能量大于生成物总能量,该反应放热,即△H=-(E1-E2)kJ/mol;
故答案为:-(E1- E2)或(E2-E1);
②焓变=正反应的活化能-逆反应的活化能,可得到-241.8kJ/mol=167.2kJ/mol-逆反应的活化能,即逆反应的活化能为:241.8+167.2=409 kJ/mol;
故答案为:409。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
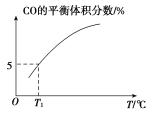
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。