题目内容
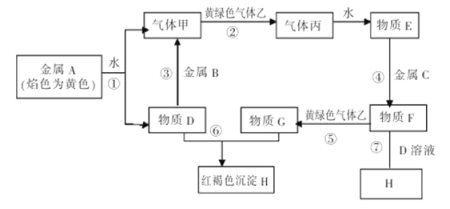
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
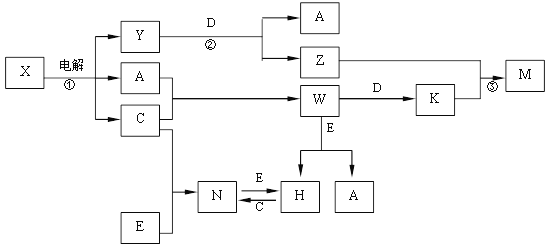
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
【答案】(1)![]() ,4,Ⅷ;
,4,Ⅷ;
(2) 2Cl-+2 H2O![]() 2OH-+Cl2↑+ H2↑;2Al+2OH-+2 H2O=2AlO2-+ 3H2↑;Al3++3AlO2-+6H2O = 4Al(OH)3↓;
2OH-+Cl2↑+ H2↑;2Al+2OH-+2 H2O=2AlO2-+ 3H2↑;Al3++3AlO2-+6H2O = 4Al(OH)3↓;
(3)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;②ClO-+2I-+2H+=I2+Cl-+H2O ,35.75% 。
【解析】试题分析:根据问题(3),推出C为氯气,因此是电解饱和食盐水,X为NaCl,A为氢气,Y为NaOH,D和NaOH产生H2,则D为Al,K为AlCl3,M为Al(OH)3,E和盐酸反应生成氢气,则E为金属,N是金属氯化物,E和Cl2反应,说明E是变价金属,即E为Fe,N为FeCl3,H为FeCl2,(1)NaOH属于离子化合物,其电子式为![]() ;(2)①根据上述推断,离子反应方程式为:2Cl-+2 H2O
;(2)①根据上述推断,离子反应方程式为:2Cl-+2 H2O![]() 2OH-+Cl2↑+ H2↑;反应②的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应③的离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)①制取漂白粉,用氯气和氢氧化钙的反应,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,②ClO-+2I-+2H+=I2+Cl-+H2O ,建立关系式ClO-~I2~2Na2S2O3,m(Ca(ClO)2)=20×10-3×0.1×250×143/(2×2×25)g=0.715g,则漂白粉的有效成分质量分数为0.715/2×100%=35.75%。
2OH-+Cl2↑+ H2↑;反应②的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应③的离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)①制取漂白粉,用氯气和氢氧化钙的反应,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,②ClO-+2I-+2H+=I2+Cl-+H2O ,建立关系式ClO-~I2~2Na2S2O3,m(Ca(ClO)2)=20×10-3×0.1×250×143/(2×2×25)g=0.715g,则漂白粉的有效成分质量分数为0.715/2×100%=35.75%。

【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
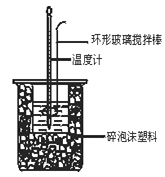
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。