题目内容
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,16 gN2H4在氧气中完全燃烧生成氮气,放出热量312 kJ。N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。负极的电极反应方程式是 。
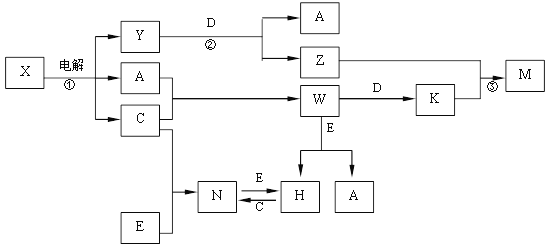
(3)下图是一个电化学过程示意图。

① 锌片上发生的电极反应方程式是 。
② 假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
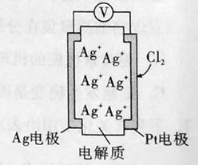
(5)将0.3 mol AgNO3、0.4 mol Cu(NO3)2和0.1mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,当阴极生成0.1mol气体时,此时,另一极上的气体体积(标准状况)为 。
【答案】(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-624KJ/mol;
(2)O2+2H2O+4e-=4OH-;N2H4+4OH—-4e-=N2+4H2O;
(3)①Cu2++2e-=Cu;②112;(4)2NH3+ClO-=N2H4+Cl-+H2O (5) 6.72L
【解析】
试题分析:(1)16gN2H4的物质的量是0.5mol,所以1molN2H4完全燃烧生成氮气和液态水放出的热量是624kJ,则N2H4完全燃烧反应的热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O(l) △H=-624.0kJ/mol;
(2)燃料电池中正极发生还原反应,元素的化合价降低,所以是氧气发生还原反应,结合电解质溶液,正极反应的电极反应式为O2+4e-+2H2O=4OH-;负极则是燃料发生反应,根据(1)判断N2H4的氧化产物是氮气,所以负极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(3)①该装置是电解池装置,Zn是阴极,发生还原反应,所以是铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu;
②铜片作阳极,发生氧化反应,所以Cu片逐渐溶解,质量减少128g,即Cu的物质的量减少2mol,失去电子4mol,根据整个过程满足得失电子守恒规律,所以氧气得电子的物质的量也是4mol,根据O2 +4e-+2H2O=4OH-可知需要氧气得物质的量是1mol,标准状况下的体积是22.4L,空气中氧气体积含量为20%,所以需要空气的体积是22.4L/20%=112L;
(4)NaClO氧化NH3,制得肼的稀溶液,则Cl元素被还原为氯离子,根据元素守恒,产物中还有水生成,离子方程式为ClO-+2NH3=N2H4+Cl-+H2O。
(5)Ag+和Cl-反应生成AgCl沉淀,反应后溶液中存在0.4molCu2+、0.1molK+、0.2molAg+、1.1molNO3-,阴极生成0.1mol气体,这说明溶液中的铜离子和银离子完全放电,然后是氢离子放电,则转移电子是0.4mol×2+0.2mol+0.1mol×2=1.2mol,则根据阳极反应4OH--4e-=O2+2H2O可知转移1.2mol电子,生成0.3molO2,则气体的体积为0.3mol×22.4L/mol=6.72L。