题目内容
【题目】有科学家预青,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
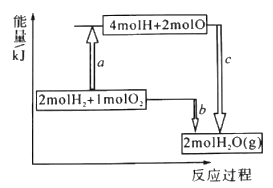
(1)已知破坏1moIH-H键、1molO=O键、1molH -O键时分别需要吸收436kJ、498kJ、465kJ的能量,下图表示H2、O2转化为H2O的反应过程中的能量变化,则b=_______。
(2)在l0lkPa下,lg氢气完全燃烧生成液态水放出142. 9kJ的热量,该反应的热化学方程式为_______。
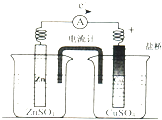
(3)为探究实验室制氢气反应的热效应,选择下图装置进行实验。

①若x为水,y为生石灰,则实验过程中U形管中可观察到的现象是___________。
②若x为稀盐酸,y为锌粒,观察到与①相同的实验现象,则说明锌与稀盐酸制氢气的反应是_________(填“放热反应”或“吸热反应”)。
(4)已知:
H2SO4 (aq) +2KOH (aq)=K2SO4 (aq)+2H2O(1) △H =Q1kJ/mol
H2SO4(浓)+2NaOH(aq) =Na2SO4 (aq) +2H2O(1) △H =Q2 kJ/mol
HNO3 (aq)+KOH(aq)=KNO3 (aq)+H2O(l) △H =Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3值的大小关系为________。
【答案】 490 2H2(g)+O2(g)=2H2O(1) △H=-571. 6kJ.mol- l 左端液柱降低,右端液柱升高 放热反应 Q2<Q1=2Q3
【解析】(1)化学反应中,化学键的断裂需要吸收能量,形成新化学键放出能量,反应热等于反应物键能之和减去生成物的总键能之和.(2)1g氢气的物质的量为1g/2g·mol-1=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,结合物质的状态及焓变书写热化学方程式.(3)生石灰与水反应放热,大试管内气体受热鼓胀;
(1)反应2H2(g)+O2(g)=2H2O(g)的能量变化如图1所示.已知拆开1molH2、1molO2和1molH-O中的化学键分别需要消耗436KJ、498KJ和465KJ能量,2molH2和1molO2参加反应断裂化学键吸收的能量为:2×436kJ+498kJ=1370kJ,即a值,生成2molH2O(g)形成新化学键放出的能量为:4×463kJ=1852kJ,即C值,反应的焓变△H=2×436KJ·mol-1+498KJ·mol-1-2×2×465KJ·mol-1=-490KJ·mol-1,即b值。(2)1g氢气的物质的量为1g/2g·mol-1=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,则该反应的热化学方程式是2H2(g)+O2(g)=2H2O(1) △H=-571. 6kJ.mol- l ;(3)①若x为水,y为生石灰,生石灰与水反应放热,大试管内气体受热鼓胀,则实验过程中U形管中可观察到的现象是左端液柱降低,右端液柱升高。②若x为稀盐酸,y为锌粒,观察到与①相同的实验现象,则说明锌与稀盐酸制氢气的反应是“放热反应”;(4)反应均为溶液中的反应,浓硫酸稀释放热可知,H2SO4(浓)+2NaOH(aq) =Na2SO4 (aq) +2H2O(1) △H =Q2 kJ/mol,该反应放出热量增加,Q2<Q1,H2SO4 (aq) +2KOH (aq)=K2SO4 (aq)+2H2O(1) △H =Q1kJ/mol,生成2molH2O放出的热量是HNO3 (aq)+KOH(aq)=KNO3 (aq)+H2O(l) △H =Q3 kJ/mol生成1mol水的2倍,Q1=2Q3,则Q1、Q2、Q3值的大小关系为 Q2<Q1=2Q3。

 阅读快车系列答案
阅读快车系列答案