题目内容
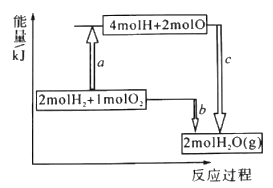
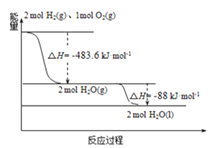
【题目】T ℃,分别向10 mL浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是

A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA)=0.1 mol·L-1,pH=4
C. 弱酸HB的pKa≈5
D. 酸性:HA<HB
【答案】C
【解析】A.弱酸的Ka只与温度有关,温度一定,其数值是一定的,其不随溶液浓度的变化而变化,A不正确;B. 由图中信息可知,a点对应的溶液中lgc(HA)=1、2pH=4。所以c(HA)=0.1 mol·L-1、pH=2,B不正确;C. 由图中信息可知,lgc(HB)=0即c(HB)= 1 mol·L-1时,2pH=5,则pH=2.5,c(H+)=![]() mol·L-1,c(B-)
mol·L-1,c(B-)![]() c(H+)=
c(H+)=![]() mol·L-1,所以,弱酸HB的Ka≈
mol·L-1,所以,弱酸HB的Ka≈![]() ,pKa≈5,C正确;D. 由图中信息可知,1 mol·L-1的两种弱酸HA、HB的2pH分别是3和5,所以HA的酸性强于HB,D不正确。本题选C。
,pKa≈5,C正确;D. 由图中信息可知,1 mol·L-1的两种弱酸HA、HB的2pH分别是3和5,所以HA的酸性强于HB,D不正确。本题选C。

练习册系列答案
相关题目