题目内容
2.下列说法正确的是( )| A. | 二氧化硫具有还原性 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
分析 A.二氧化硫中S元素处于中间价态,所以二氧化硫具有氧化性和还原性;
B.二氧化硫的漂白性具有暂时性特点;
C.二氧化硫、氮氧化物是形成酸雨的成分;
D.浓硫酸作干燥剂是利用其吸水性.
解答 解:A.二氧化硫中S元素处于中间价态,所以二氧化硫具有氧化性和还原性,能被强氧化剂高锰酸钾溶液等物质氧化,故A正确;
B.二氧化硫的漂白性具有暂时性特点,加热会导致恢复原色,故B错误;
C.二氧化硫、氮氧化物是形成酸雨的成分,二氧化碳是造成温室效应的气体,故C错误;
D.浓硫酸作干燥剂是利用其吸水性,与其脱水性无关,故D错误;
故选A.
点评 本题考查二氧化硫的还原性、漂白性及污染和浓硫酸的性质,知道化合价与物质性质的关系,注意二氧化硫漂白性和次氯酸的区别,注意浓硫酸吸水性和脱水性区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.将下列各种液体①苯 ②四氯化碳 ③碘化钾溶液 ④己烯⑤己烷,分别与适量溴水混合后充分振荡、静置,液体分为两层,上层几乎是无色的是( )
| A. | 只有② | B. | 只有②④ | C. | ②④⑤ | D. | ①②③④ |
10.下列有关核外电子排布的式子不正确的是( )
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的价电子排布式:4s1 | |
| C. | 氮原子的轨道表示式: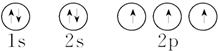 | |
| D. | 硫原子的轨道表示式: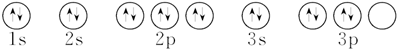 |
17.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
| A. | 碳的燃烧热为110.5kJ.mo1-1 | |
| B. | 反应①的反应热为221 kJ.mo1-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1 mo1水时放出热量大于57.3 kJ | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成l mo1水时放出57.3 kJ的热量 |
14.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 75 | 74 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Y的最高价氧化物对应的水化物显两性 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | X、Y元素的金属性 X<Y | |
| D. | X2+离子半径大于W2-离子半径 |
12.下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
元素周期表
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
元素周期表
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
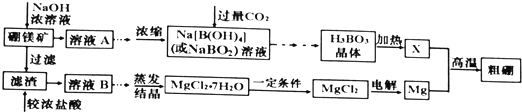
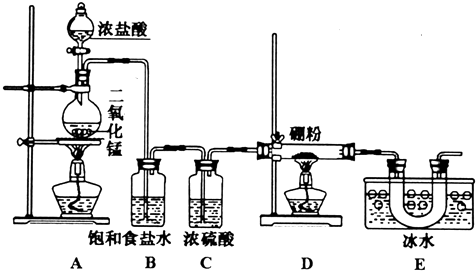
 ;
;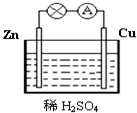 图为原电池的示意图.请回答:
图为原电池的示意图.请回答: