��Ŀ����
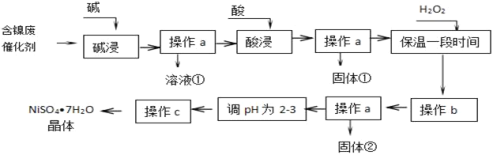
����Ŀ�����ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�á�ͼ�ױ�ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ������������˵������ȷ����(����)
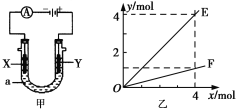
A. ����װ�����ڵ�⾫��ͭ����XΪ��ͭ��YΪ��ͭ��������Һa����������ͭ���Ȼ�ͭ��Һ
B. ��ͼ��װ���ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ��ͨ��һ��ʱ�����0.5 mol��̼��ͭ�պûָ���ͨ��ǰ��Ũ�Ⱥ�pH�����������ת�Ƶĵ���Ϊ2.0 mol
C. ��ͼ��װ���ö��Ե缫���AgNO3��Һ����ͼ�Һ�����x��ʾ����缫�ĵ��ӵ����ʵ�������E�ɱ�ʾ��Ӧ������������ʵ�����F��ʾ���������������ʵ���
D. ��X��YΪ���缫��a��ҺΪ500 mL KCl��KNO3�Ļ��Һ������һ��ʱ����������õ���״����11.2 L���壬��ԭ���Һ��KCl�����ʵ���Ũ������Ϊ2.0 mol��L��1
���𰸡�B
��������
A.��⾫��ͭ��ͭ����������ͭ����������YΪ��ͭ��XΪ��ͭ��������Һa����������ͭ���Ȼ�ͭ��Һ���ʲ�ѡA��
B.���ݡ�����ʲô����ʲô���ķ���֪���������ͭ��Һʱ����������������ͭ������ԭ���غ�֪��0.5mol��̼��ͭ��ͭԪ�ص����ʵ�����0.5mol�������ϵĵ缫��ӦʽΪ��Cu2++2e-=Cu����������0.5molͭ��Ҫת�Ƶ��ӵ����ʵ�����1mol����ѡB��
C.�������ĵ�ⷽ��ʽΪ��4AgNO3+2H2O![]() O2��+4HNO3+4Ag�����ݷ���ʽ֪����ת��4mol����ʱ����1mol������4mol���ᣬ��ͼ���Ǻϣ��ʲ�ѡC��
O2��+4HNO3+4Ag�����ݷ���ʽ֪����ת��4mol����ʱ����1mol������4mol���ᣬ��ͼ���Ǻϣ��ʲ�ѡC��
D.���500 mL KCl��KNO3�Ļ��Һ�������������ӷŵ�����������2Cl--2e-=Cl2���������ӷ�Ӧ������4OH��4e-=2H2O+O2����������2H++2e-=H2�����������õ���״����11.2 L��0.5mol���壬���OH-�ŵ磬����������Ͳ������ʵ�����ȣ�������Һ�������ӵ����ʵ���������1mol��Ũ�������ǣ�![]() =2mol/L���ʲ�ѡD��
=2mol/L���ʲ�ѡD��

����Ŀ������ͼ��װ�ý���ʵ�飬ʵ��һ��ʱ���������Ԥ�ⲻһ�µ���

�������� | �������� | ʵ��Ԥ�� | |
A | Ũ��ˮ | ��̪��Һ | ������Һ��Ϊ��ɫ |
B | Ũ���� | ����KI��Һ | ������Һ��Ϊ��ɫ |
C | Ũ���� | Ũ��ˮ | ���ձ����а��� |
D | ���͵���������Һ | ϡ��ˮ | ���������Ա仯 |
A. AB. BC. CD. D