题目内容
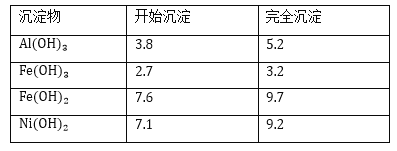
【题目】镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
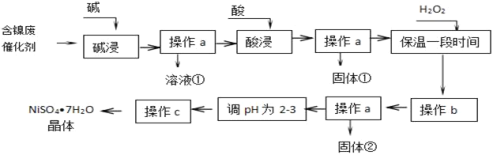
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是_________;
(2)用离子方程式表示加入双氧水的目的______________;双氧水可以用下列物质替代的是_________
A.氧气 ![]() 漂白液
漂白液 ![]() 氯气
氯气 ![]() 硝酸;
硝酸;
(3)操作b调节溶液pH范围为______________;
(4)操作a和c需要共同的玻璃仪器是_______;上述流程中,防止浓缩结晶过程中,Ni2+水解的措施是_______。
【答案】AlO2- 2Fe2++H2O2+2H+=2Fe3++2H2O A 3.2![]() pH<7.1 玻璃棒 调节溶液pH为2--3
pH<7.1 玻璃棒 调节溶液pH为2--3
【解析】
(1)根据废料成分知,碱和铝、氧化铝反应,溶液中含有偏铝酸根离子;
(2)根据数据表知,应将亚铁离子转化成铁离子除去,且不能引入新的杂质离子;
(3)调节溶液pH使Fe3+完全沉淀,使Ni2+不沉淀,分离出固体是氢氧化铁;
(4)过滤、蒸发都需要用玻璃仪器:玻璃棒;硫酸镍是强酸弱碱盐,根据盐的水解规律判断选择的条件。
(1)碱和铝、氧化铝均能反应,溶液中含有的含有金属的离子是AlO2-;
(2)亚铁离子具有还原性,双氧水具有氧化性,加入双氧水是为了氧化亚铁离子成为铁离子,离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O。选项的物质都具有强的氧化性,会把Fe2+氧化为Fe3+,但漂白液(主要成分次氯酸钠)、氯气、硝酸替代双氧水会引入新杂质,而氧气不能引入杂质离子,故可以用作替代试剂为氧气,合理选项是A;
(3)由表格可知,氢氧化铁的沉淀范围为,2.7-3.2,镍离子的沉淀范围是7.1-9.2,调节溶液的pH在3.2-7.1,既可以除去杂质铁离子,而又不使镍离子形成沉淀;
(4)操作a是过滤得到固体和滤液,操作c是蒸发浓缩得到晶体过滤得到NiSO47H2O,操作a、c中均需使用的仪器为玻璃棒;镍离子水解使溶液呈酸性,根据盐的水解规律,为抑制镍离子水解,溶液始终保持酸性,调节溶液pH为2—3。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③