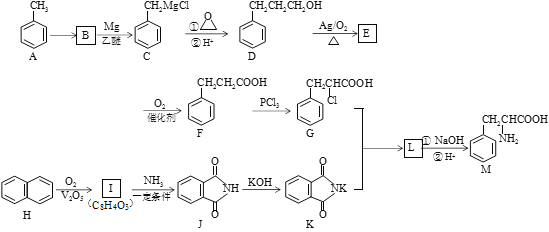
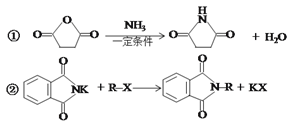
题目内容
【题目】已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是
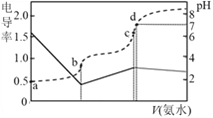
A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) > c(CH3COOH)
C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)
D. c点水的电离程度小于d点
【答案】D
【解析】分析:氨水逐滴滴入盐酸和醋酸的混合液中,依次发生的反应为:HCl+NH3·H2O=NH4Cl、CH3COOH+NH3·H2O=CH3COONH4+H2O;盐酸为强酸,随着氨水的滴入,溶液的体积变大,溶液中离子浓度变小,溶液的电导率逐渐变小,当盐酸恰好完全反应时电导率最小,b点为等浓度的NH4Cl和CH3COOH的混合液;继续滴加氨水,弱酸醋酸与氨水反应生成强电解质CH3COONH4,溶液中离子浓度变大,溶液的电导率又逐渐变大,c点为等浓度的NH4Cl和CH3COONH4的混合液;醋酸恰好完全反应后,继续滴加氨水,氨水属于弱碱水溶液,溶液中离子浓度又变小,溶液的导电率又变小。A项,由CH3COOH的电离平衡常数、盐酸和醋酸的浓度计算;B项,b点为等浓度的NH4Cl和CH3COOH的混合液,根据NH3·H2O的Kb计算NH4+的水解平衡常数,比较NH4+的水解平衡常数与CH3COOH的Ka;C项,c点为等浓度的NH4Cl和CH3COONH4的混合液,根据物料守恒判断;D项,分析c点和d点溶液的组成,根据酸、碱、盐对水的电离平衡的影响判断。
详解:氨水逐滴滴入盐酸和醋酸的混合液中,依次发生的反应为:HCl+NH3·H2O=NH4Cl、CH3COOH+NH3·H2O=CH3COONH4+H2O;盐酸为强酸,随着氨水的滴入,溶液的体积变大,溶液中离子浓度变小,溶液的电导率逐渐变小,当盐酸恰好完全反应时电导率最小,b点为等浓度的NH4Cl和CH3COOH的混合液;继续滴加氨水,弱酸醋酸与氨水反应生成强电解质CH3COONH4,溶液中离子浓度变大,溶液的电导率又逐渐变大,c点为等浓度的NH4Cl和CH3COONH4的混合液;醋酸恰好完全反应后,继续滴加氨水,氨水属于弱碱水溶液,溶液中离子浓度又变小,溶液的导电率又变小。A项,a点没有滴入氨水,盐酸为强酸,醋酸为弱酸,醋酸的电离方程式为CH3COOH![]() CH3COO-+H+,设溶液中c(CH3COO-)=xmol/L,则溶液中c(H+)=(0.01+x)mol/L,c(CH3COOH)=(0.01-x)mol/L,Ka(CH3COOH)=
CH3COO-+H+,设溶液中c(CH3COO-)=xmol/L,则溶液中c(H+)=(0.01+x)mol/L,c(CH3COOH)=(0.01-x)mol/L,Ka(CH3COOH)=![]() =
=![]() =1.7
=1.7![]() 10-5,由于HCl电离的H+抑制CH3COOH的电离,0.01+x
10-5,由于HCl电离的H+抑制CH3COOH的电离,0.01+x![]() 0.01,0.01-x
0.01,0.01-x![]() 0.01,解得x
0.01,解得x![]() 1.7
1.7![]() 10-5,c(CH3COO-)的数量级约为10-5,A项正确;B项,根据上述分析,b点为等浓度的NH4Cl和CH3COOH的混合液,NH4Cl属于强酸弱碱盐,NH4+的水解离子方程式为NH4++H2O
10-5,c(CH3COO-)的数量级约为10-5,A项正确;B项,根据上述分析,b点为等浓度的NH4Cl和CH3COOH的混合液,NH4Cl属于强酸弱碱盐,NH4+的水解离子方程式为NH4++H2O![]() NH3·H2O+H+,NH4+的水解平衡常数Kh(NH4+)=
NH3·H2O+H+,NH4+的水解平衡常数Kh(NH4+)=![]() =KW/Kb(NH3·H2O)=1
=KW/Kb(NH3·H2O)=1![]() 10-14
10-14![]() (1.7
(1.7![]() 10-5)=5.88
10-5)=5.88![]() 10-10
10-10![]() Ka(CH3COOH),NH4+的水解程度小于CH3COOH的电离程度,b点溶液中c(NH4+)
Ka(CH3COOH),NH4+的水解程度小于CH3COOH的电离程度,b点溶液中c(NH4+)![]() c(CH3COOH),B项正确;C项,根据上述分析,c点为等浓度的NH4Cl和CH3COONH4的混合液,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH),C项正确;D项,c点为等浓度的NH4Cl和CH3COONH4的混合液,NH4Cl、CH3COONH4水解促进水的电离,d点为等浓度的NH4Cl、CH3COONH4和略过量的氨水组成的混合液,过量的氨水对水的电离起抑制作用,c点水的电离程度大于d点,D项错误;答案选D。
c(CH3COOH),B项正确;C项,根据上述分析,c点为等浓度的NH4Cl和CH3COONH4的混合液,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH),C项正确;D项,c点为等浓度的NH4Cl和CH3COONH4的混合液,NH4Cl、CH3COONH4水解促进水的电离,d点为等浓度的NH4Cl、CH3COONH4和略过量的氨水组成的混合液,过量的氨水对水的电离起抑制作用,c点水的电离程度大于d点,D项错误;答案选D。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案