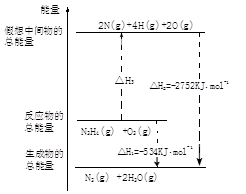题目内容
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题: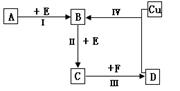
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为 ,F分子的电子式为 。
②反应 I 的化学方程式为 。
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质。NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式 。
④ X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g·mol–1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于 晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为 。
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式 。
(1)①三角锥形(1分) H:O:H ② 4NH3 + 5O2 4NO + 6H2O(2分) ③3NaN3 = 4N2↑ + Na3N(2分) ④6NO2 + 8NH3 = 7N2 + 12H2O或6NO + 4NH3 = 5N2 + 6H2O 或 6NOx + 4xNH3 = (3+2x)N2 + 6xH2O(2分)
4NO + 6H2O(2分) ③3NaN3 = 4N2↑ + Na3N(2分) ④6NO2 + 8NH3 = 7N2 + 12H2O或6NO + 4NH3 = 5N2 + 6H2O 或 6NOx + 4xNH3 = (3+2x)N2 + 6xH2O(2分)
(2)①离子(1分) ②4FeS2 + 11O2 2Fe2O3 + 8SO2(2分) ③S2– + 4ClO– = SO42– + 4Cl–(2分)
2Fe2O3 + 8SO2(2分) ③S2– + 4ClO– = SO42– + 4Cl–(2分)
解析试题分析:位于相邻周期、相邻主族、最高价氧化物的水化物均为强酸的两种短周期非金属元素,只能是氮元素和硫元素。
(1)由A的一个分子中都只含有10个电子可知X为是N元素,结合转化关系图可推知A为NH3,B、C、D、E、F分别为NO、NO2、HNO3、O2和H2O。①NH3的空间构型为三角锥形,H2O的电子式为H:O:H。②反应Ⅰ为氨气的催化氧化,生成NO和H2O。③NaX3为NaN3,受撞击后生成Na3N和N2。④氮的氧化物(NO、NO2等)都可以与NH3反应生成无毒害的物质N2和H2O。
(2)Y为硫元素,则B、C、D分别为SO2、SO3和H2SO4,由A+O2→SO2且A的摩尔质量为120g·mol–1可推知A为FeS2(硫铁矿主要成分)。①反应IV为铜与浓硫酸的反应,将溶液蒸干可得到硫酸铜晶体,硫酸铜晶体属于离子晶体。②反应Ⅰ为FeS2与O2反应生成Fe2O3和SO2。③ClO–具有强氧化性,其还原产物为Cl–,因产物无沉淀,所以S2–的氧化产物不是单质硫,只能是SO42–(SO32–还可进一步被氧化),故该反应的离子方程式为:S2– + 4ClO– = SO42– + 4Cl–。
考点:考查氮、硫化合物的相互转化;元素推断和物质推断;提供信息书写化学方程式;分子空间构型、电子式的书写、晶体类型的判断等内容。

(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。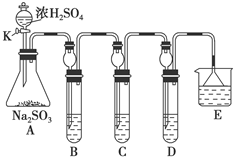
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入 ______ | __________ |
__________________________________________________。

 2KNO2+O2↑
2KNO2+O2↑ 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑ 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑