题目内容
15.某校化学兴趣小组在实验中发现一瓶溶液,标签上标有“CaCl2 0.1mol•L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( )| A. | 配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中 | |
| B. | Ca2+和Cl-的物质的量浓度都是0.1 mol•L-1 | |
| C. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol•L-1 |
分析 标签上标有“CaCl2 0.1mol•L-1”的字样,即在1L的溶液中含1molCaCl2.
A.溶液的体积≠溶剂的体积;
B.在CaCl2中,Ca2+和Cl-的物质的量之比为1:2;
C.溶液是均一稳定的;
D.将溶液稀释一倍,则浓度减半.
解答 解:标签上标有“CaCl2 0.1mol•L-1”的字样,即在1L的溶液中含1molCaCl2.
A.将0.1mol CaCl2溶于1L水中,所得溶液的体积大于1L,故A错误;
B.在CaCl2中,Ca2+和Cl-的物质的量之比为1:2,则浓度之比也为1:2,故Ca2+的浓度为0.1mol/L,而Cl-的浓度应为0.2mol/L,故B错误;
C.溶液是均一稳定的,浓度与取出的溶液的体积是多少无关,故C错误;
D.溶液中Cl-的浓度为0.2mol/L,将溶液稀释一倍,则浓度减半,故稀释后Cl-的浓度应为0.1mol/L,故D正确.
故选D.
点评 本题考查了溶液的配制方法和溶液中离子浓度的比值关系等问题,难度不大,掌握好基础知识是关键.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
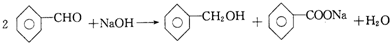
5. 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
查阅相关文献,可能用到的有关数据如下:
表1:有关物质的密度、沸点、溶解性
表2:苯甲酸为白色片状晶体,熔点122.4℃,苯甲酸在水中的溶解度见下表
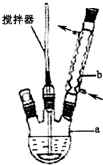
实验方法:在图示反应装置中,加入反应物搅拌下控温55℃回流至瓶内物质成糊状后完成.拆除装置,往仪器a中加入适量水,搅拌使固体溶解,然后将反应混合物转入分液漏斗中,用30ml萃取剂分3次萃取.往萃取后的水层中加入30g碎冰,在搅拌下慢慢加入浓HCl至湿润的紫色石蕊试纸变红,冰水浴中冷却析出苯甲酸粗品.请回答下列问题:
(1)写出装置图中玻璃仪器的名称,a三颈烧瓶,b(球形)冷凝管.
(2)为了进一步提纯苯甲酸,通常采用重结晶法进行.在进行该实验过程中需要趁热过滤.将粗笨甲酸全溶后往往需要再加入少量蒸馏水的目的是为了减少趁热过滤过程中损失苯甲酸.
(3)将提炖后的产品进行洗涤、干燥.检验经上述操作后得到的是否是纯净的苯甲酸的常用方法是测定获得产品的熔点是否是122.4℃.
(4)在整个过程中,若苯甲醛所取的质量为2.120g,最终获取的纯净笨甲酸的质量为1.098g,则苯甲酸的产率为90.0%.
(5)某同学认为可从弃去的萃取有机层中获取笨甲醇,为完成该实验需要的玻璃仪器有温度计、尾接管及蒸馏烧瓶、直形冷凝管、锥形瓶.
 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
查阅相关文献,可能用到的有关数据如下:
表1:有关物质的密度、沸点、溶解性
| 物质 | 相对分子 质量 | 密度/ (相对于水) | 沸点/℃ | 溶解性 |
| 苯甲醛 | 106 | 1.046 | 178.8 | 微溶于水,可混溶于乙醇、乙醚、苯、氯仿 |
| 苯甲醇 | 108 | 1.042 | 205.7 | 溶于水,易溶于乙醇、醚、芳烃 |
| 苯甲酸 | 122 | 1.271 | 249.2 | 微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳 |
| 苯甲酸钠 | 144 | 1.442 | 249.3 | 溶于水和乙醇、甘油、苯、甲醇、微溶于乙醚 |
| 温度/℃ | 25 | 50 | 95 |
| 溶解度/g | 0.17 | 0.95 | 6.8 |
(1)写出装置图中玻璃仪器的名称,a三颈烧瓶,b(球形)冷凝管.
(2)为了进一步提纯苯甲酸,通常采用重结晶法进行.在进行该实验过程中需要趁热过滤.将粗笨甲酸全溶后往往需要再加入少量蒸馏水的目的是为了减少趁热过滤过程中损失苯甲酸.
(3)将提炖后的产品进行洗涤、干燥.检验经上述操作后得到的是否是纯净的苯甲酸的常用方法是测定获得产品的熔点是否是122.4℃.
(4)在整个过程中,若苯甲醛所取的质量为2.120g,最终获取的纯净笨甲酸的质量为1.098g,则苯甲酸的产率为90.0%.
(5)某同学认为可从弃去的萃取有机层中获取笨甲醇,为完成该实验需要的玻璃仪器有温度计、尾接管及蒸馏烧瓶、直形冷凝管、锥形瓶.
6.下列实验的现象与对应结论均不正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 将一块Al箔在酒精灯火焰上灼烧 | Al箔熔融而不滴落 | Al与氧气不反应 |
| C | 将一小块Na放入硫酸铜溶液中 | 有铜单质析出 | Na能置换出硫酸铜中的铜 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
3. 某化学兴趣小组根据反应:Mg+H2SO4═MgSO4+H2↑设计测定镁原子摩尔质量的实验,实验的简易装置如图,除去表面氧化膜的镁条的质量为0.24g.镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积),下列关于该实猃的叙述不正确的是( )
某化学兴趣小组根据反应:Mg+H2SO4═MgSO4+H2↑设计测定镁原子摩尔质量的实验,实验的简易装置如图,除去表面氧化膜的镁条的质量为0.24g.镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积),下列关于该实猃的叙述不正确的是( )
 某化学兴趣小组根据反应:Mg+H2SO4═MgSO4+H2↑设计测定镁原子摩尔质量的实验,实验的简易装置如图,除去表面氧化膜的镁条的质量为0.24g.镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积),下列关于该实猃的叙述不正确的是( )
某化学兴趣小组根据反应:Mg+H2SO4═MgSO4+H2↑设计测定镁原子摩尔质量的实验,实验的简易装置如图,除去表面氧化膜的镁条的质量为0.24g.镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积),下列关于该实猃的叙述不正确的是( )| A. | 实验前应检验装置的气密性 | |
| B. | 装置乙中的水不可以用NaCl溶液代替 | |
| C. | 读数时,应使装置乙和装置丙中的液面处于同一水平面上 | |
| D. | 镁原子的摩尔质量为24.0 g.mol-1 |
10.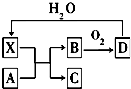 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | 工业上,B转化为D的反应条件为高温、高压、使用催化剂 | |
| B. | 若A为铁,则足量A与X在室温下即可发生反应 | |
| C. | 若A为碳单质,则将少量C通入足量NaClO溶液中,产物为NaHCO3和HClO | |
| D. | X使蔗糖变黑的现象主要体现了X的强氧化性 |
20.水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法和压渗法等.下列方法中,不可以用来进行海水淡化的是( )
| A. | 过滤法 | B. | 蒸馏法 | C. | 膜分离法 | D. | 离子交换法 |
7.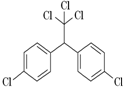 DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构为:下列有关说法正确的是( )
DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构为:下列有关说法正确的是( )
 DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构为:下列有关说法正确的是( )
DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构为:下列有关说法正确的是( )| A. | DDT属于卤代烃类 | |
| B. | DDT完全燃烧后只产生CO2和H2O两种物质 | |
| C. | DDT分子中有一个手性碳 | |
| D. | 氢核磁共振谱图中有5种位置峰 |
5.下列有关实验操作及说法正确的是( )
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000mol•L-1的溶液 | |
| B. | 某待测液中先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色,该待测液中一定含有Fe2+ | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.