题目内容
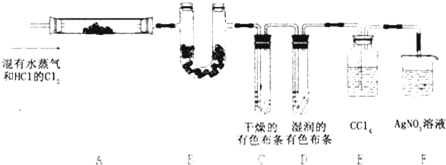
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。

(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热
②KMnO4和浓盐酸混合 ③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合
A.①②③ B.①②④ C.①② D.全部可以
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是 。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。
(1)D (2)浓盐酸随着反应的进行浓度逐渐降低,最终变为稀盐酸,反应不再产生氯气
(3)①证明有水蒸气产生 白色固体变蓝色
②氯气无漂白性,氯气与水反应产生的次氯酸有漂白性
③吸收氯气
(1)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2)Cl2+2NaClO2=2ClO2+2NaCl
【解析】
试题分析:(1)MnO2、KMnO4、NaClO3、K2Cr2O7都具有强氧化性,与浓盐酸反应都能生成Cl2,故D项正确。
(2)浓盐酸随着反应的进行浓度逐渐降低,最终变为稀盐酸,反应不再产生氯气,HCl为0.2mol,所以生成的Cl2小于0.05mol,小于1.12L。
(3)①装置B中盛有无水硫酸铜,所起的作用为证明水蒸气的存在;现象为:白色固体变蓝色。
②装置D和E的区别在于布条是否干燥,而在湿润的布条中,氯气与水反应生成次氯酸,因此这两个装置说明了“氯气无漂白性,次氯酸有漂白性”。
③要检验有HCl挥发出来,需要除去Cl2,所以装置E的作用是:吸收氯气。
漂白粉长期放置于空气中,Ca(ClO)2与CO2、H2O反应生成HClO,HClO分解使漂白粉失效。
Cl2把NaClO2中的+3价Cl氧化为ClO2,配平可得化学方程式。
考点:本题考查氯气的制取及性质、化学方程式的书写。

 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案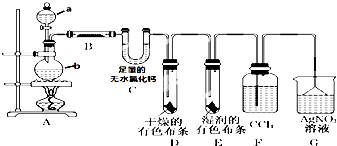 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称