题目内容
已知下列两个热化学方程式:2CO(g) + O2(g) = 2CO2(g)△H =- 586.7 kJ/mol
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ/mol,实验测得:CO与H2的混合气体5.8g,完全燃烧时,放出的热量为87.25KJ,则混合气体中CO和H2的体积比为 ( )
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ/mol,实验测得:CO与H2的混合气体5.8g,完全燃烧时,放出的热量为87.25KJ,则混合气体中CO和H2的体积比为 ( )
| A.1 :1 | B.2 :1 | C.2 :3 | D.1 :3 |
B
试题分析:设CO xmol,H2 ymol,则 28x+2y=5.8
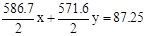
解得 x=0.2 y=0.1,所以体积比为2:1。
答案选B。
点评:本题用十字交叉法更简单。

练习册系列答案
相关题目
 )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知 完全发生上述反应放出
完全发生上述反应放出 的热量,热化学方程式是:
的热量,热化学方程式是: CO+3H2的焓变△H=_______。
CO+3H2的焓变△H=_______。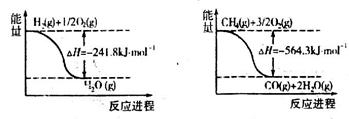
 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为  可知,金刚石比石墨稳定
可知,金刚石比石墨稳定 (aq))+OH
(aq))+OH (aq))=H
(aq))=H O(l)△H=-57.3 kJ·mol
O(l)△H=-57.3 kJ·mol 的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1 CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
 增大的有 。
增大的有 。 E.2α2=α3
E.2α2=α3