题目内容
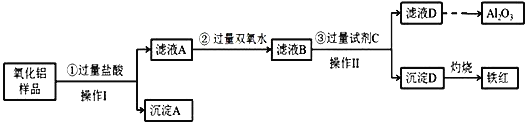
【题目】某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
(1)操作I的名称是_________,该操作用到的玻璃棒的作用:_______________。
(2)沉淀A的成分是__________(填化学式);
(3)滤液D焰色反应呈黄色,试剂C是____________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
【答案】过滤 引流 SiO2 NaOH Al3++4OH-=AlO2-+2H2O
【解析】
Al2O3样品中含有Fe2O3、FeO和SiO2,加入过量盐酸,金属氧化物溶解生成氯化铝、氯化铁、氯化亚铁溶液,过滤得到沉淀A为SiO2,滤液A含氯化铁、氯化亚铁和氯化铝、盐酸,加入过量H2O2,氯化亚铁被氧化为氯化铁,向得到滤液B中加入过量强碱NaOH溶液,生成Fe(OH)3沉淀和NaAlO2溶液,过滤得到沉淀D为Fe(OH)3,滤液D为含AlO2-溶液,向滤液中通入过量CO2气体反应生成Al(OH)3沉淀和NaHCO3,将氢氧化铝沉淀过滤、洗涤、干燥,然后加热分解生成氧化铝,沉淀D灼烧得到铁红——氧化铁,据此解答。
根据上述分析可知:沉淀A是SiO2,滤液A含有FeCl3、FeCl2、AlCl3、HCl,向滤液A中加入足量H2O2,FeCl2被氧化为FeCl3;滤液B中物质成分为FeCl3、AlCl3、HCl,
向滤液B中加入过量试剂C为强碱NaOH溶液,发生反应:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;过滤得到沉淀D为Fe(OH)3,滤液D为含AlO2-、OH-溶液,向滤液D中通入过量CO2气体,AlO2-反应生成Al(OH)3沉淀,将氢氧化铝沉淀过滤、洗涤、干燥,然后加热分解生成氧化铝,沉淀D灼烧得到铁红——氧化铁。
(1)操作I是分离难溶性固体和溶液混合物的方法,操作的名称是过滤,该操作用到的玻璃棒的作用是引流;
(2)沉淀A的成分是SiO2;
(3)滤液D焰色反应呈黄色,说明含有钠元素,加入的试剂C是NaOH溶液;在步骤③中Al3+与过量OH-反应的离子方程式为:Al3++4OH-=AlO2-+2H2O。