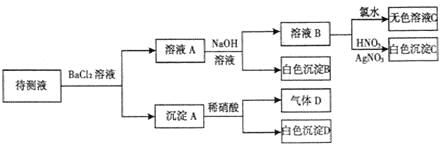
题目内容
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是
( )
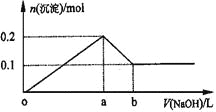
A.混合溶液中Al3+的物质的量为0.2mol
B.NaOH的浓度为0.5 mol/L
C.在b点处溶液中的溶质只有NaAlO2
D.图中线段oa:ab=5:1
【答案】D
【解析】
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,加入aLNaOH溶液时,沉淀达最大值共0.2mol,此时溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,据此解答。
A、根据图示信息和Al原子守恒有:n(NaAlO2)=n(AlCl3)=n[Al(OH)3]=0.1mol,故A错误;
B、在bL时,溶液为NaCl、NaAlO2溶液,由图象可知:n[Al(OH)3]=0.1mol,n(Mg(OH)2]=0.1mol,根据Mg原子守恒有n(MgCl2)=n(Mg(OH)2]=0.1mol,根据Al原子守恒有n(NaAlO2)=n(AlCl3)=n[Al(OH)3]=0.1mol,由Cl原子守恒有n(Cl)=n(NaCl)=2n(MgCl2)+3n(AlCl3)=2×0.1mol+3×0.1mol=0.5mol,由Na原子守恒有n(NaOH)=n(NaCl)+n(NaAlO2)=0.5mol+0.1mol=0.6mol,所以c(NaOH)=0.6mol÷1L=0.6mol/L,故B错误;
C、在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,故C错误;
D、加入aLNaOH溶液时,沉淀达最大值共0.2mol,由反应方程式可知,此时溶液为NaCl溶液,在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝与NaOH恰好反应,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,所以两部分NaOH溶液的体积之比等于消耗的NaOH的物质的量之比,即为n(NaCl)与n(NaAlO2)之比,故oa:ab=a:(b-a)=0.5mol:0.1mol=5:1,故D正确。
故选D。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化