题目内容
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
【答案】A
【解析】
A. 10 mL pH=1的醋酸溶液中,n(H+)=0.01L×0.1mol/L=0.001mol,氢离子数为0.001NA,A正确;
B. 合成氨反应为可逆反应,1 mol N2与4 mol H2反应生成的NH3分子数小于2NA,B不正确;
C.消耗MnO2 8.7g时,转移电子![]() =0.1mol,按电子守恒,生成氯气0.05mol,标况下体积为1.12L,C不正确;
=0.1mol,按电子守恒,生成氯气0.05mol,标况下体积为1.12L,C不正确;
D. 18.4 g NO2和18.4 g N2O4都含有0.4molN原子,则混合气体中含有的氮原子总数为0.4NA,D不正确;
故选A。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】日常生活中,汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
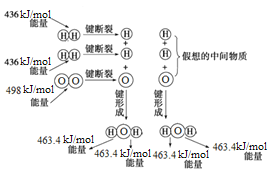
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH= -akJ/mol
2CO2(g) ΔH= -akJ/mol
②N2(g)+O2(g) ![]() 2NO(g) ΔH= +bkJ/mol
2NO(g) ΔH= +bkJ/mol
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH= -ckJ/mol
2NO2(g) ΔH= -ckJ/mol
回答下列问题:
(1)CO的燃烧热为____________________。
(2)CO将NO2还原为单质的热化学方程式为_____________________________。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率V(N2)=_________________________________。
②能说明上述反应达到平衡状态的是_______________。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
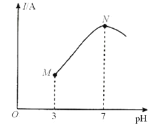
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。

则NO的平衡转化率随温度升高而减小的原因是______________________________
图中压强(P1、P2、P3)的大小顺序为_____________________。