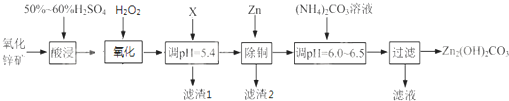
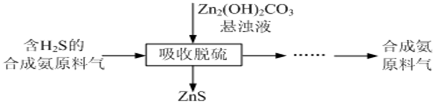
题目内容
1.在标准状况下,448mL某气体的质量为0.64g,计算这种气体的相对分子质量为32.分析 根据n=$\frac{V}{{V}_{m}}$计算气体物质的量,再根据M=$\frac{m}{n}$计算气体相对分子质量.
解答 解:在标准状况下,448mL某气体的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,
该气体的质量为0.64g,则其摩尔质量为$\frac{0.64g}{0.02mol}$=32g/mol,
故该气体的相对分子质量为32,
故答案为:32.
点评 本题考查物质的量计算,比较基础,注意掌握相对分子质量计算方法,可以先计算气体的密度,再根据M=ρVm计算.

练习册系列答案
相关题目
9.下列是生活中常见的几种药物,
阿司匹林: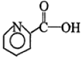 芬必得:
芬必得: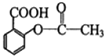
扑热息痛: 维生素B5:
维生素B5: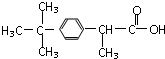
有关这些物质的说法正确的是( )
阿司匹林:
 芬必得:
芬必得:
扑热息痛:
 维生素B5:
维生素B5:
有关这些物质的说法正确的是( )
| A. | 都含有苯环 | B. | 碳原子都共平面 | ||
| C. | 都能与Na2CO3反应 | D. | 都能水解 |
6.下列说法或表示方法正确的是( )
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |
13.关于下列各装置图的叙述中,正确的是( )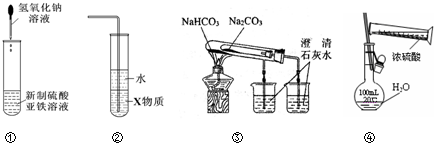

| A. | 利用装置①可制备氢氧化亚铁并长时间观察其颜色 | |
| B. | 装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸 | |
| C. | 装置③验证Na2CO3和NaHCO3两种固体的热稳定性 | |
| D. | 通过④的方法配制一定浓度的稀硫酸溶液 |
10.常温下,下列各组离子在指定溶液中不能大量共存的是( )
| A. | 澄清透明的溶液中:MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$、K+、Fe3+ | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- | |
| C. | 使pH试纸变红的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| D. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- |
11.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-393.5 kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol |