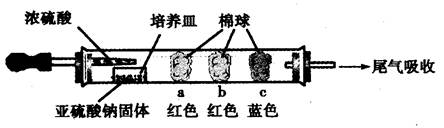
题目内容
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
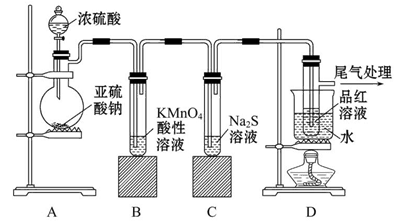
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。
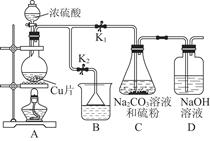
Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
则判断达到滴定终点的现象是 ,废水中Ba2+的物质的量浓度 _。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。

Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 | | | | |
| 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
则判断达到滴定终点的现象是 ,废水中Ba2+的物质的量浓度 _。
(1)①S2O32-+2H+=S↓+SO2↑+H2O ②蒸发浓缩 冷却结晶 ③NaOH
④浓硫酸浓度不够或铜被氧化或固体中含不与浓硫酸反应的杂质等合理答案均可
(2)加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变 9.6×10-4 mol·L-1
④浓硫酸浓度不够或铜被氧化或固体中含不与浓硫酸反应的杂质等合理答案均可
(2)加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变 9.6×10-4 mol·L-1
(1)制取Na2S2O3·5H2O的原理为SO2首先与C装置中的Na2CO3溶液反应生成Na2SO3,然后发生反应S+Na2SO3=Na2S2O3,过量的SO2会产生酸性环境,根据题意Na2S2O3在酸性条件下易发生反应S2O32-+2H+=S↓+SO2↑+H2O,一部分S2O32-反应时消耗H+可使溶液pH增大,最后过滤除去硫单质,将滤液蒸发浓缩、冷却结晶,过滤即可得Na2S2O3·5H2O。装置B的作用是处理尾气,其中所盛液体为NaOH溶液。
(2)平行测定的四组数据中有一组为“离群数据”,舍去,其他三组数据取平均值为18.00 mL。根据题意可得关系式:Ba2+~BaCrO4~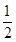 Cr2O72-~
Cr2O72-~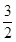 I2~3Na2S2O3。故废水中Ba2+的物质的量浓度为
I2~3Na2S2O3。故废水中Ba2+的物质的量浓度为
c(Ba2+)=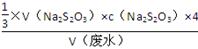 =
=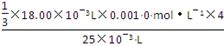 =9.6×10-4 mol·L-1。
=9.6×10-4 mol·L-1。
(2)平行测定的四组数据中有一组为“离群数据”,舍去,其他三组数据取平均值为18.00 mL。根据题意可得关系式:Ba2+~BaCrO4~
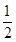 Cr2O72-~
Cr2O72-~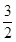 I2~3Na2S2O3。故废水中Ba2+的物质的量浓度为
I2~3Na2S2O3。故废水中Ba2+的物质的量浓度为c(Ba2+)=
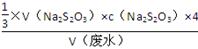 =
=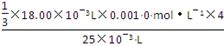 =9.6×10-4 mol·L-1。
=9.6×10-4 mol·L-1。
练习册系列答案
相关题目
 H2SO3
H2SO3