题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如方程式①②所示:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=+49.0kJmol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g);△H=-192.9kJmol-1
O2(g)=CO2(g)+2H2(g);△H=-192.9kJmol-1
③H2(g)+![]() O2(g)=H2O(g);△H=-241.8kJmol-1
O2(g)=H2O(g);△H=-241.8kJmol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJmol-1
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据以上反应可知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJmol-1
O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJmol-1
【答案】D
【解析】
A.燃烧热中生成液态水,已知反应中无液态水,不能计算![]() 的燃烧热,故A错误;
的燃烧热,故A错误;
B.反应![]() 为吸热反应,图中为放热反应,二者不符,故B错误;
为吸热反应,图中为放热反应,二者不符,故B错误;
C.![]() 均可实现
均可实现![]() 转变成
转变成![]() 的过程,
的过程,![]() 为放热反应,
为放热反应,![]() 为吸热反应,故C错误;
为吸热反应,故C错误;
D.由盖斯定律可知, ![]() 可得:
可得: ![]() ,则
,则 ![]() ,故 D正确。
,故 D正确。
故选D。

 小学教材全测系列答案
小学教材全测系列答案【题目】淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=﹣105kJmol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
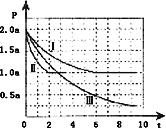
(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
【题目】下列说法不正确的是
A.1 mol 冰中拥有2 mol氢键
B.分子晶体中既有范德华力,又有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
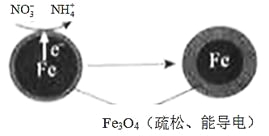
①作负极的物质是________。
②正极的电极反应式是_________。
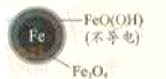
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
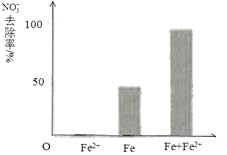
pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:_________。