题目内容
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
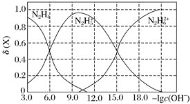
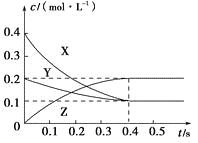
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。

pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:_________。
【答案】(1)①铁 ②NO3-+8e-+10H+=NH4++3H2O,
(2)FeO(OH)不导电,阻碍电子转移
(3)①本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率。
②Fe2++2FeO(OH)=Fe3O4+2H+, Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子的转移。
(4)初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足。
【解析】
试题用零价铁去除水体中的硝酸盐,(1)①Fe还原水体中的NO3-的反应原理图可知,Fe被氧化作负极,答案为:铁;②正极是硝酸根离子被还原为NH4+,该溶液为酸性电解质溶液,结合元素和电荷守恒可知电极反应式为:NO3-+8e-+10H+=NH4++3H2O,答案为:NO3-+8e-+10H+=NH4++3H2O;(2)从PH对硝酸根去除率的影响来看,初始pH=4.5时去除率低,主要是应为铁离子容易水解生成FeO(OH),同时生成的Fe3O4产率降低,且生成的FeO(OH)不导电,所以NO3-的去除率低,答案为:FeO(OH)不导电,阻碍电子转移,(3)①从右图可以看出只加入铁粉和只加入Fe2+,NO3-的去除率都不及同时加入铁和亚铁离子硝酸根的去除率高,说明不是应用了亚铁离子的还原性提高的硝酸根的去除率的,而是由于Fe2+破坏FeO(OH)生成了四氧化三铁,答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;②同位素示踪法证实Fe2+能与FeO(OH)反应生成四氧化三铁,该反应的离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,加入Fe2+之所以可以提高硝酸根离子的转化率主要因为较少了FeO(OH)的生成,生成更多的Fe3O4,增强了导电性,另外生成了H+,可以是pH增大的速度减慢,使NO3-的转化率增大;(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3-的去除率越低,答案为:初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
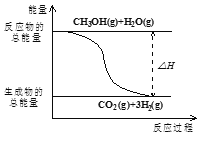
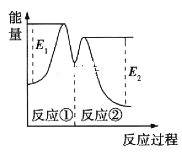
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是
A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)