题目内容
2.反应H2(g)+Cl2(g)→2HCl(g)的能量变化可用如图表示,下列说法不正确的是( )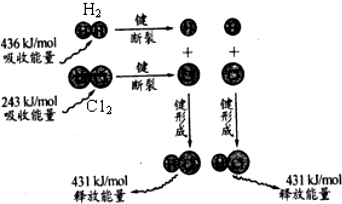
| A. | 该反应在光照和点燃条件下的反应热效应是相同的 | |
| B. | 氢气分子中的化学键比氯气分子中的化学键更稳定 | |
| C. | 2mol气态氢原子的能量低于1mol氢气 | |
| D. | 氢气与氯气反应的热化学方程式:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol |
分析 A、反应热△H的数值与反应条件无关;
B、H-H键的键能大于Cl-Cl键;
C、断裂化学键要吸收能量;
D、反应热△H=断键吸收的能量-成键所放出的能量.
解答 解:A、反应热△H的数值取决于反应物和生成物的总能量,与反应条件无关,故无论在光照还是在点燃的条件下,热效应是相同的,故A正确;
B、H-H键的键能大于Cl-Cl键,即断开1molH-H键所需要的能量大于断开1molCl-Cl所需的能量,即氢气分子中的化学键比氯气分子中的化学键更稳定,故B正确;
C、断裂化学键要吸收能量,故将1mol氢气中的H-H断开后需要吸收能量,则导致2mol氢原子的能量高于1mol氢气,故C错误;
D、反应热△H=断键吸收的能量-成键所放出的能量=(436+243)-2×431=-183kJ/mol,故D正确.
故选C.
点评 本题考查了热化学方程式的书写、能量高低的判断等问题,应注意的是反应热△H的数值取决于反应物和生成物的总能量,与反应条件无关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.已知某脂肪酸(用R表示)有以下实验记录:
则以下关于R的结论肯定不正确的是( )
| 组成元素 | 官能团 | 相对分子质量 | 与碱反应 | 加成反应 |
| C、H、O | 羧基、碳碳双键 | 小于300 | 14.0gR可被2.0gNaOH中和 | 2.8gR可与448mLH2(标准状况)反应 |
| A. | R是一元羧酸 | B. | R分子在烃基为C17H${\;}_{3{1}^{-}}$ | ||
| C. | R的相对分子质量为280 | D. | R分子含一个碳碳双键 |
10.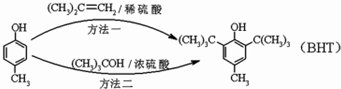 BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )
 BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )| A. | 方法一和方法二的反应类型分别是取代和加成反应 | |
| B. |  与BHT互为同系物 与BHT互为同系物 | |
| C. |  能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 | |
| D. | 1molBHT可与含有2molBr2的浓溴水发生取代反应 |
17.下列物质的电子式书写正确的是( )
| A. | 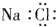 | B. |  | C. |  | D. | 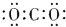 |
14.向明矾[KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,当SO42-完全沉淀时,铝元素的存在形式是( )
| A. | 全部为Al(OH)3沉淀 | |
| B. | 几乎全部以AlO2-形式存在于溶液中 | |
| C. | 一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中 | |
| D. | 一部分为Al(OH)3沉淀,一部分以AlO3-形式存在于溶液中 |
11.下列物质的类别与所含官能团都正确的是( )
| A. | 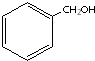 酚-OH 酚-OH | B. |  羧酸-COOH 羧酸-COOH | C. | 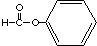 醛-CHO 醛-CHO | D. | CH3-O-CH3 酮 |
12.下列表示正确的是( )
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |
 原电池是把化学能转化为电能的装置,请回答下列问题:
原电池是把化学能转化为电能的装置,请回答下列问题: