题目内容
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1________T2(填“>”或“<”)。
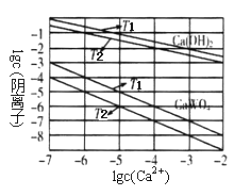
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
【答案】+62MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2OHAsO32-+H2O2=HAsO42-+H2O<WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-1×103WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
2MnO2+2Na2WO4+2H2OHAsO32-+H2O2=HAsO42-+H2O<WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-1×103WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
【解析】
由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和氢氧化锰,水浸时,氧化铁和氢氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2,钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,氧化+5价的钨为+6价,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4、MgHPO4,过滤,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨.
(1)根据在化合物中正负化合价代数和为零,确定钨酸盐(FeWO4、MnWO4)中钨元素的化合价;根据流程图的提示锰的钨酸盐和氢氧化钠和氧气反应生成MnO2等物质;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,据此书写离子反应方程式;
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。由图读出溶解度和温度的关系,确定温度的高低;将钨酸钠溶液加入石灰乳得到钨酸钙沉淀和氢氧根离子,据此书写离子反应式,反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积的比,据此计算T2时该反应的平衡常数;
(4)电解时阴极得到电子,由于电解质溶液是酸性介质,所以阴极是氢离子放电生成氢气,碳化钨做阳极,碳化钨(WC)失去电子生成H2WO4.
(1)钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+x+(-2)×4=0,解得x=+6,黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,转化中生成MnO2的化学反应方程式为2MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2O;
2MnO2+2Na2WO4+2H2O;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。从图看出当钙离子浓度相同时,T2时阴离子浓度小,所对应温度高,T1<T2;将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-,T2时,C(OH-)=10-2mol·L-1,c(WO42-)=10-7mol·L-1,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积的比,即K=C2(OH-)C(WO42-)=(10-2)2/10-7=1×103;
(4)电解时,阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑,阳极是碳化钨失去电子,发生氧化反应:WC+6H2O-10e-=H2WO4+CO2↑+10H+,

 金博士一点全通系列答案
金博士一点全通系列答案