题目内容
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )A.该反应的化学平衡常数表达式是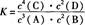 |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增大C,B的平衡转化率不变 |
D
试题分析:根据三段式进行计算:3A(g)+2B(g)
 4C(?)+2D(?)
4C(?)+2D(?)初始物质的量(mol) 4 2 0 0
转化物质的量(mol) 1,2 0.8 1.6 0.8
反应后物质的量(mol)2.8 1.2 1.6 0.8
因为压强之比等于气体物质的量之比,所以反应后气体的物质的量=6mol×4/5=4.8mol,则生成物C不是气体,D为气体。A、因为C为纯液体,不能出现在K的表达式中,则化学平衡常数表达式错误; B、生成1.6molC时,反应的B的物质的量为0.8mol,则B的平衡转化率为0.8mol÷2mol×100%=40%,错误;C、由于温度没变,化学平衡常数不变,错误; D、由于C为液体,增加C对平衡没影响,B的平衡转化率不变,正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率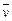 (X)(表示反应物的消耗速率或生成物的生成速率)为
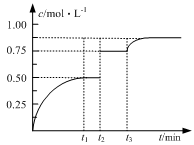
(X)(表示反应物的消耗速率或生成物的生成速率)为 xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件(温度、体积、催化剂或一种物质),测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件(温度、体积、催化剂或一种物质),测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是