题目内容
【题目】高氯酸铵![]() 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
![]() 高氯酸铵中氯元素的化合价为_____________。
高氯酸铵中氯元素的化合价为_____________。
![]() 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H![]() 和三种单质气体,请写出该分解反应的化学方程式____________________________。
和三种单质气体,请写出该分解反应的化学方程式____________________________。
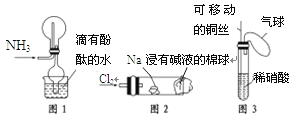
![]() 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。![]() 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气![]()

![]() 装置A、B、C、D中盛放的药品可以依次为__________
装置A、B、C、D中盛放的药品可以依次为__________![]() 选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ![]() 。
。
Ⅰ![]() 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
Ⅱ![]() 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
Ⅲ![]() 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
![]() 装置E收集到的气体可能是_____________
装置E收集到的气体可能是_____________![]() 填化学式
填化学式![]() 。
。
![]() 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)![]() NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取![]() ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
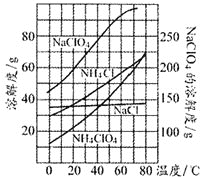
![]() 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH![]() ClO
ClO![]() 晶体的实验操作依次为________、_________和过滤、洗涤、干燥。
晶体的实验操作依次为________、_________和过滤、洗涤、干燥。
![]() 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH![]() Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________。
Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________。
![]() 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH![]() ClO
ClO![]() 的质量分数。
的质量分数。![]() 已知:NH
已知:NH![]() ClO
ClO![]() 的相对分子质量为
的相对分子质量为![]() ;NH
;NH![]() ClO
ClO![]() 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为![]() ,
,![]() N
N![]() H
H![]()
![]()
![]() N
N![]()
![]()
实验步骤:
步骤Ⅰ![]() 称取
称取![]() 样品。
样品。
步骤Ⅱ![]() 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ![]() 移取
移取![]() 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入![]() 的中性甲醛溶液
的中性甲醛溶液![]() 过量
过量![]() ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入![]() 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复![]() 滴定
滴定![]() 操作2次。
操作2次。

![]() 标准液应盛放在上图装置_________
标准液应盛放在上图装置_________![]() 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ”![]() 中,判断达到滴定终点的现象是__________。
中,判断达到滴定终点的现象是__________。
![]() 滴定结果如下表所示:
滴定结果如下表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | |
1 |
|
|
2 |
|
|
3 |
|
|
则所用标准溶液的体积为___________mL,若NaOH标准溶液的浓度为![]() ,则该产品中
,则该产品中![]() 的质量分数为_____________。
的质量分数为_____________。
【答案】![]()
![]() Ⅱ
Ⅱ ![]() 蒸发浓缩 冷却结晶 氨气与浓盐酸反应放出热量 Ⅱ 当加入最后一滴标准液,锥形瓶内溶液由无色变成粉红色,且30s内不褪去
蒸发浓缩 冷却结晶 氨气与浓盐酸反应放出热量 Ⅱ 当加入最后一滴标准液,锥形瓶内溶液由无色变成粉红色,且30s内不褪去 ![]()
![]()
【解析】
![]() 铵根显
铵根显![]() 价,氧元素显
价,氧元素显![]() 价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:
价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:![]() ,则
,则![]() 价,故答案为:
价,故答案为:![]() ;
;
![]() 高氯酸铵在高温条件下分解会产生H2O(g)和三种单质气体,结合元素守恒,三种单质气体为N2、Cl2和O2,反应的化学方程式为:
高氯酸铵在高温条件下分解会产生H2O(g)和三种单质气体,结合元素守恒,三种单质气体为N2、Cl2和O2,反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 先利用无水硫酸铜检验水蒸气,然后用湿润的红色布条检验氯气,氢氧化钠溶液吸收氯气,浓硫酸进行干燥,D中为铜,用于检验氧气的存在,焦性没食子酸溶液用于吸收氧气,故答案为:Ⅱ;
先利用无水硫酸铜检验水蒸气,然后用湿润的红色布条检验氯气,氢氧化钠溶液吸收氯气,浓硫酸进行干燥,D中为铜,用于检验氧气的存在,焦性没食子酸溶液用于吸收氧气,故答案为:Ⅱ;
![]() 装置E收集到的气体可能是
装置E收集到的气体可能是![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由图可知,
由图可知,![]() 的溶解度受温度影响很大,NaCl的溶解度受温度影响不大,
的溶解度受温度影响很大,NaCl的溶解度受温度影响不大,![]() 、
、![]() 的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于
的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于![]() ,故从混合溶液中获得较多
,故从混合溶液中获得较多![]() 晶体的实验操作依次为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶;
晶体的实验操作依次为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶;
因氨气与浓盐酸反应放出热量,反应需要温度较低,所以氯化铵用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,故答案为:氨气与浓盐酸反应放出热量;
![]() 标准液应盛放在碱式滴定管中,即盛放在II中;因为使用酚酞作指示剂,当加入最后一滴标准液,锥形瓶内溶液由无色变成粉红色,且30s内不褪去,达到滴定终点,故答案为:Ⅱ;当加入最后一滴标准液,锥形瓶内溶液由无色变成粉红色,且30s内不褪去;
标准液应盛放在碱式滴定管中,即盛放在II中;因为使用酚酞作指示剂,当加入最后一滴标准液,锥形瓶内溶液由无色变成粉红色,且30s内不褪去,达到滴定终点,故答案为:Ⅱ;当加入最后一滴标准液,锥形瓶内溶液由无色变成粉红色,且30s内不褪去;
![]() 三次实验所耗NaOH溶液的体积依次为24.30mL-0.20mL=24.10mL、24.90mL-1.00mL=23.90mL、21.20mL-0.20mL=21.00mL,第3组实验数据误差较大,应舍去,则所用标准溶液的体积为(24.10mL+23.90mL)÷2=24.00mL,根据所给反应得出关系式
三次实验所耗NaOH溶液的体积依次为24.30mL-0.20mL=24.10mL、24.90mL-1.00mL=23.90mL、21.20mL-0.20mL=21.00mL,第3组实验数据误差较大,应舍去,则所用标准溶液的体积为(24.10mL+23.90mL)÷2=24.00mL,根据所给反应得出关系式![]() ,该产品中
,该产品中![]() 的质量分数为
的质量分数为 ,故答案为:
,故答案为:![]() ;
;![]() 。
。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案