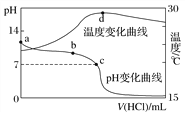
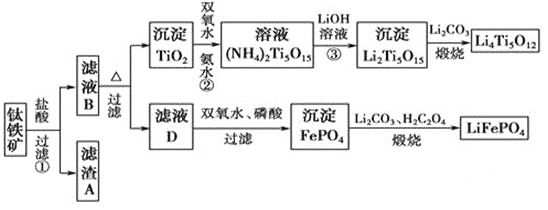
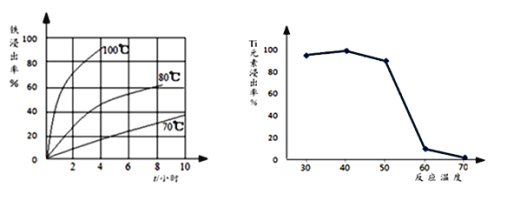
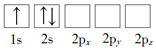
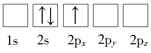
题目内容
【题目】绿矾可用作除草剂、净水剂或抗贫血药等。某研究小组同学采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、Al2O3和SiO2,不考虑其他杂质)制备绿矾,流程如下:
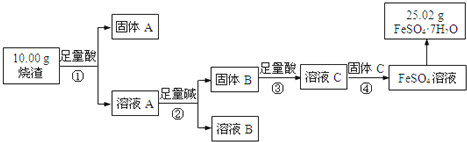
已知:固体B为红褐色固体,固体C为用途最广泛的金属,请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是__________(填序号);
(2)③中所发生反应的离子方程式是____;
(3)下列说法正确的是__________;
a①中可选用盐酸,③中应选择硫酸
b溶液B中含有OH-、SiO32-、AlO2-等阴离子
c④中发生了氧化还原反应
(4)如何检验溶液C中的阴离子?___________;
【答案】①② Fe(OH)3+3H+=Fe3++3H2O ac 取溶液C少许于试管中,加入酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含有硫酸根离子
【解析】
由流程图可知,向烧渣中加入足量酸,氧化铁和氧化铝溶于酸,SiO2和酸不反应,过滤,得到的固体A为SiO2,溶液A中含有H+、Al3+、Fe3+;向溶液A中加入足量碱,铁离子与碱反应生成氢氧化铁沉淀,铝离子与过量的碱反应生成偏铝酸钠,过滤,得到的滤液B中含有偏铝酸盐和碱,固体B为Fe(OH)3;为防止引进杂质,向固体B中加入足量稀硫酸,氢氧化铁和稀硫酸反应生成Fe2(SO4)3,溶液C中含有过量的硫酸和硫酸铁,向溶液中加入单质Fe,Fe与硫酸铁和稀硫酸发生氧化还原反应生成硫酸亚铁,然后蒸发浓缩、冷却结晶、过滤得到绿矾。
(1)通过以上分析知,采用过滤方法分离的是①②,故答案为:①②;
(2)③中所发生的反应为氢氧化铁和酸反应生成铁盐和水,反应的离子方程式为Fe(OH)3+3H+=Fe3++3H2O,故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(3)a、 ①的目的是溶解金属氧化物,③的目的是得到硫酸盐,所以①中可选用盐酸,③中只能用硫酸,故正确;
b、通过以上分析知,溶液B中含有OH-、AlO2-,不含硅酸根离子,故错误;
c、④中Fe与硫酸铁和稀硫酸发生氧化还原反应生成硫酸亚铁,Fe单质做反应的还原剂,失电子发生氧化反应,故正确;
ac正确,故答案为:ac;
(4)溶液C中的阴离子为硫酸根离子,检验硫酸根离子的操作是取溶液C少许于试管中,加入酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含有硫酸根离子,故答案为:取溶液C少许于试管中,加入酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含有硫酸根离子。

【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与![]() ,反应得富马酸亚铁。
,反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 |
| 116 |
|
碳酸 |
|
| |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100mL烧杯A中,加热水搅拌
②加入![]() 溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入![]() 溶液30mL
溶液30mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
请回答以下问题:
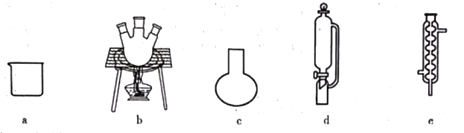
(1)该实验涉及到的主要仪器需从以上各项选择,则B为__________(填字母),C为___________(填名称)。
(2)已知反应容器中反应物![]() 和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入
和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入溶液调节pH的目的是______________________________________________;若加入
![]() 溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
(3)配制![]() 溶液方法为称取
溶液方法为称取![]() 固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
(4)步骤④中洗涤的目的主要是为了除去是___________离子,检验沉淀是否洗净的方法是:_____________。
ii.计算产品的产率:
(5)经测定,产品中富马酸亚铁的纯度为76.5%。以5.80g富马酸为原料反应制得产品8.10g,则富马酸亚铁的产率为_____________%。(保留小数点后一位)
【题目】高氯酸铵![]() 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
![]() 高氯酸铵中氯元素的化合价为_____________。
高氯酸铵中氯元素的化合价为_____________。
![]() 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H![]() 和三种单质气体,请写出该分解反应的化学方程式____________________________。
和三种单质气体,请写出该分解反应的化学方程式____________________________。
![]() 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。![]() 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气![]()
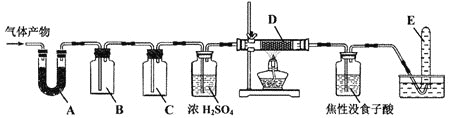
![]() 装置A、B、C、D中盛放的药品可以依次为__________
装置A、B、C、D中盛放的药品可以依次为__________![]() 选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ![]() 。
。
Ⅰ![]() 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
Ⅱ![]() 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
Ⅲ![]() 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
![]() 装置E收集到的气体可能是_____________
装置E收集到的气体可能是_____________![]() 填化学式
填化学式![]() 。
。
![]() 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)![]() NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取![]() ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
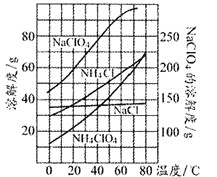
![]() 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH![]() ClO
ClO![]() 晶体的实验操作依次为________、_________和过滤、洗涤、干燥。
晶体的实验操作依次为________、_________和过滤、洗涤、干燥。
![]() 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH![]() Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________。
Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________。
![]() 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH![]() ClO
ClO![]() 的质量分数。
的质量分数。![]() 已知:NH
已知:NH![]() ClO
ClO![]() 的相对分子质量为
的相对分子质量为![]() ;NH
;NH![]() ClO
ClO![]() 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为![]() ,
,![]() N
N![]() H
H![]()
![]()
![]() N
N![]()
![]()
实验步骤:
步骤Ⅰ![]() 称取
称取![]() 样品。
样品。
步骤Ⅱ![]() 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ![]() 移取
移取![]() 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入![]() 的中性甲醛溶液
的中性甲醛溶液![]() 过量
过量![]() ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入![]() 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复![]() 滴定
滴定![]() 操作2次。
操作2次。
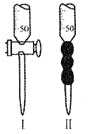
![]() 标准液应盛放在上图装置_________
标准液应盛放在上图装置_________![]() 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ”![]() 中,判断达到滴定终点的现象是__________。
中,判断达到滴定终点的现象是__________。
![]() 滴定结果如下表所示:
滴定结果如下表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | |
1 |
|
|
2 |
|
|
3 |
|
|
则所用标准溶液的体积为___________mL,若NaOH标准溶液的浓度为![]() ,则该产品中
,则该产品中![]() 的质量分数为_____________。
的质量分数为_____________。