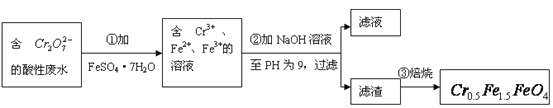
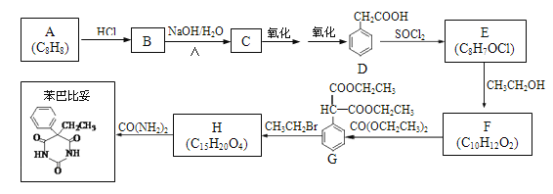
题目内容
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O部分信息如下:
物理性质 | 化学性质 |
红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂) | 具有强还原性,易被氧化 |
制备原理:2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O(s)。
某兴趣小组设计实验制备[Cr(CH3COO)2]22H2O(s)。

回答下列问题:
(1)仪器A的名称是_____。
(2)检查装置B气密性的操作方法是_____。
(3)加入盐酸后,关闭K1,打开K2,将装置B中的导管抽出液面以上一段时间,目的是____。反应开始后,从装置B中看到的现象是溶液由深绿色(Cr3+)变为亮蓝色(Cr2+),且有气泡产生。写出装置B中发生的非置换反应的离子方程式:_____。
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,宜采取的操作是_____;装置D中导管口水封的目的是_____。
(5)将装置C中所得产品提纯,其操作依次为过滤、去氧水洗涤、乙醚洗涤。相对乙醇或水,用乙醚洗涤的优点有______。
(6)测定产品纯度:取ag产品溶于蒸馏水,通入足量空气,充分反应后,加入过量氢氧化钠溶液,过滤、洗涤、灼烧、称重。得Cr2O3质量为mg(假设杂质不参与反应),[Cr(CH3COO)2]22H2O(s)的摩尔质量为Mg·mol-1。测得产品纯度为____ %。(用含a、m、M的代数式表示)
【答案】分液漏斗 关闭K2,打开K1,由分液漏斗向锥形瓶中加入蒸馏水,当蒸馏水不再下滴时,表明装置B气密性良好 排尽装置内空气 2Cr3++Zn=2Cr2++ Zn2+ 将装置B中的导管插入液面以下 避免空气进入装置C中 减少产品损失、干燥快(或减少产品氧化的量) ![]()
【解析】
(1)根据装置图判断仪器A的名称;
(2)检查装置B气密性,首先要形成封闭体系;其次,缩小气体的体积,增大气体的压强;最后观察现象,据此分析解答;
(3)由于[Cr(CH3COO)2]22H2O(s) 具有强还原性,易被氧化,需要将装置内的空气排出;反应开始后,装置B中盐酸与锌的反应是置换反应,Cr3+与Zn的反应为非置换反应,据此分析解答;
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,可以通过气压作用,将装置B中的CrCl3溶液压入装置C中;装置D中导管口水封,可以避免空气进入装置C中;
(5)根据 [Cr(CH3COO)2]22H2O(s)为红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂),具有强还原性,易被氧化,据此分析解答;
(6) Cr2O3质量为mg,可以求出n(Cr2O3),根据Cr元素守恒,可以求出[Cr(CH3COO)2]22H2O(s)的物质的量,进而求出其质量,最后计算产品纯度。
(1)根据装置图,仪器A为分液漏斗,故答案为:分液漏斗;
(2)检查装置B气密性,首先要形成封闭体系;其次,缩小气体的体积,增大气体的压强;最后观察现象;因此具体操作和现象为:关闭K2,打开K1,由分液漏斗向锥形瓶中加入蒸馏水,当蒸馏水不再下滴时,表明装置B气密性良好,故答案为:关闭K2,打开K1,由分液漏斗向锥形瓶中加入蒸馏水,当蒸馏水不再下滴时,表明装置B气密性良好;
(3)加入盐酸后,关闭K1,打开K2,由于[Cr(CH3COO)2]22H2O(s) 具有强还原性,易被氧化,需要将装置内的空气排出,将装置B中的导管抽出液面以上一段时间,可以排尽装置内空气。反应开始后,从装置B中看到的现象是溶液由深绿色(Cr3+)变为亮蓝色(Cr2+),且有气泡产生,其中装置B中盐酸与锌的反应是置换反应,Cr3+与Zn的反应为非置换反应,该反应的离子方程式为2Cr3++Zn=2Cr2++ Zn2+,故答案为:排尽装置内空气;2Cr3++Zn=2Cr2++ Zn2+;
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,可以通过气压作用,将装置B中的CrCl3溶液压入装置C中,因此需要将装置B中的导管插入液面以下;装置D中导管口水封,可以避免空气进入装置C中,故答案为:将装置B中的导管插入液面以下;避免空气进入装置C中;
(5) [Cr(CH3COO)2]22H2O(s)为红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂),将装置C中所得产品提纯,其操作依次为过滤、去氧水洗涤、乙醚洗涤。相对乙醇或水,乙醚不能溶解该产品,且乙醚乙挥发,用乙醚洗涤可以减少产品损失、干燥快;该产品在空气中放置的时间越长,被氧化的量越大,用乙醚洗涤也可以减少产品损失,故答案为:减少产品损失、干燥快(或减少产品氧化的量);
(6) Cr2O3质量为mg,则n(Cr2O3)=![]() =
= ![]() mol,根据Cr元素守恒,[Cr(CH3COO)2]22H2O(s)的物质的量为
mol,根据Cr元素守恒,[Cr(CH3COO)2]22H2O(s)的物质的量为![]() mol,则产品纯度为
mol,则产品纯度为 ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() 。
。