题目内容
【题目】Ⅰ:已知亚磷酸![]() 是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
(1)亚磷酸与银离子反应的离子方程式为_______________________。
(2)向亚磷酸溶液中滴加氢氧化钠溶液至中性,写出所得溶液中电荷守恒方程式_________________。
(3)某温度下,![]() 的亚磷酸溶液的pH为1.4,即
的亚磷酸溶液的pH为1.4,即![]() ,则该温度下亚磷酸的一级电离平衡常数
,则该温度下亚磷酸的一级电离平衡常数![]() _________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
_________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
Ⅱ:焦亚硫酸钠![]() 在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
(5)由于![]() 具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中
具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中![]() 的残留量时,取40mL葡萄酒样品,用
的残留量时,取40mL葡萄酒样品,用![]() 的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中
的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中![]() 的残留量为___________
的残留量为___________ ![]() (以
(以![]() 计)。
计)。
【答案】![]()
![]() ,加上
,加上![]() 、
、![]() 也可 0.0094
也可 0.0094 ![]() 当加入最后一滴标准液时,溶液恰好由无色变为蓝色,且半分钟不恢复 0.16
当加入最后一滴标准液时,溶液恰好由无色变为蓝色,且半分钟不恢复 0.16
【解析】
Ⅰ:(1)亚磷酸与银离子反应时,P元素化合价由+3价变为+5价、Ag元素由+1价变为0价,根据转移电子守恒配平方程式;
(2)溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒。
(3)其电离程度较小,所以溶液中c(H2PO3-)≈c(H+)=3.9×10-2mol·L-1,c(H3PO3)≈0.20mol·L-1,代入电离平衡常数表达式计算;
Ⅱ:(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2。
(5)滴定终点的现象为溶液恰好由无色变为蓝色,且半分钟不恢复;由题意知![]() ,由此计算。
,由此计算。
Ⅰ:(1)亚磷酸是二元弱酸,与银离子反应的离子方程式为:![]() 。
。
(2)中性时,![]() ,所以电荷守恒方程式为c(Na+)=c(H2PO3-)+2c(HPO32-),加上
,所以电荷守恒方程式为c(Na+)=c(H2PO3-)+2c(HPO32-),加上![]() 、
、![]() 也可。
也可。
(3)其电离程度较小,所以溶液中c(H2PO3-)≈c(H+)=3.9×10-2mol·L-1,c(H3PO3)≈0.20mol·L-1,代入电离平衡常数表达式计算,![]() 。
。
Ⅱ:(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2,反应方程式为:
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2,反应方程式为:![]() ;
;
(5)滴定终点的现象为溶液恰好由无色变为蓝色,且半分钟不恢复;由题意知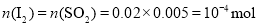 ,故
,故![]() 的残留量为:
的残留量为:![]() 。
。

【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O部分信息如下:
物理性质 | 化学性质 |
红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂) | 具有强还原性,易被氧化 |
制备原理:2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O(s)。
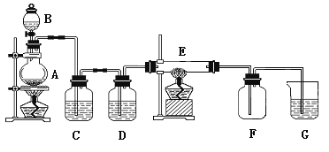
某兴趣小组设计实验制备[Cr(CH3COO)2]22H2O(s)。

回答下列问题:
(1)仪器A的名称是_____。
(2)检查装置B气密性的操作方法是_____。
(3)加入盐酸后,关闭K1,打开K2,将装置B中的导管抽出液面以上一段时间,目的是____。反应开始后,从装置B中看到的现象是溶液由深绿色(Cr3+)变为亮蓝色(Cr2+),且有气泡产生。写出装置B中发生的非置换反应的离子方程式:_____。
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,宜采取的操作是_____;装置D中导管口水封的目的是_____。
(5)将装置C中所得产品提纯,其操作依次为过滤、去氧水洗涤、乙醚洗涤。相对乙醇或水,用乙醚洗涤的优点有______。
(6)测定产品纯度:取ag产品溶于蒸馏水,通入足量空气,充分反应后,加入过量氢氧化钠溶液,过滤、洗涤、灼烧、称重。得Cr2O3质量为mg(假设杂质不参与反应),[Cr(CH3COO)2]22H2O(s)的摩尔质量为Mg·mol-1。测得产品纯度为____ %。(用含a、m、M的代数式表示)