题目内容
14.实验室模拟回收某废旧含镍催化剂(主要成份为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3.其工艺流程为如图1: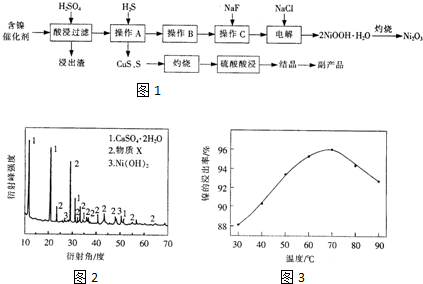
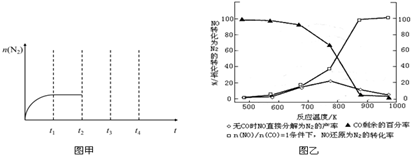
(1)根据图2所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为BaSO4.图3表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是温度升高,Ni2+的水解程度增大.
(2)工艺流程中副产品的化学式为CuSO4•5H2O.
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F浓度为3×10-3mol•L-1,则Ca2+的浓度为3×10-6mol•L-1.(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH•H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
分析 (1)含镍催化剂中含有氧化钡,能和稀硫酸反应生成白色沉淀硫酸钡,所以根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为BaSO4;由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大;
(2)CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾
(3)用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol•L-1,再计算出钙离子的浓度;
(5)Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子.
解答 解:(1)由于含镍催化剂中含有氧化钡,能和稀硫酸反应生成白色沉淀硫酸钡,所以根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为BaSO4;由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大,
故答案为:BaSO4; 温度升高,Ni2+的水解程度增大;
(2)由于CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4•5H2O,
故答案为:CuSO4•5H2O;
(3)由于用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+,
故答案为:方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol•L-1,则Ca2+的浓度为$\frac{2.7×1{0}^{-11}}{(3×1{0}^{-3})^{2}}$=3×10-6 mol/L,
故答案为:3×10-6;
(5)Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-,
故答案为:ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
点评 该题以废旧含镍催化剂生产Ni2O3为载体,重点考查学生对工艺流程试题了解掌握情况,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力;该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 氰酸铵(NH4OCN)与尿素[CO(NH2)2]都是共价化合物 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
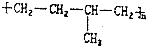 的是( )
的是( )| A. | 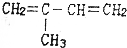 | B. | 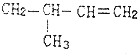 | ||
| C. | CH3CH═CH2和CH2═CH2 | D. | CH3CH═CH2 |
| 化学键 | H-H | Cl-Cl | H-Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 | 436kJ | 243kJ | 431kJ |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ•mol-1 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ•mol-1 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183kJ•mol-1 |
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是( )
| A. | △H=-2 878 kJ•mol-1 | B. | △H=-2 658 kJ•mol-1 | ||
| C. | △H=-1 746 kJ•mol-1 | D. | △H=-1 526 kJ•mol-1 |
| A. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则浓 H2SO4和 Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是 283.0 kJ/mol,则 2CO2(g)═2CO(g)+O2(g)反应的△H=2×283.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 |
 已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )
已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )| A. | 该物质与水反应,属于氧化还原反应 | |
| B. | Al2H6在空气中完全燃烧,产物为氧化铝和水 | |
| C. | Al2H6分子中 氢为+1价,铝为-3价 | |
| D. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |