题目内容
【题目】下列离子方程式中书写正确的是( )
A.碳酸氢钙溶液跟盐酸反应:HCO3-+H+=H2O+CO2↑
B.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
C.碳酸氢钠溶液和氢氧化钙溶液混合HCO3-+OH-=CO32-+H2O
D.碳酸钠溶液中滴加少量盐酸CO32-+2H+=CO2↑+H2O
【答案】A
【解析】
A. 碳酸氢钙溶液跟盐酸反应生成氯化钙、二氧化碳和水:HCO3-+H+=H2O+CO2↑,故A正确;
B. 氯气跟水反应生成盐酸和次氯酸,HCl是强酸,HClO是弱酸:Cl2+H2O![]() H++Cl-+HClO,故B错误;
H++Cl-+HClO,故B错误;
C. 少量氢氧化钙溶液与碳酸氢钠溶液混合的离子反应方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-;
足量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++OH-+HCO3-═H2O+CaCO3↓;故C错误;
D. 碳酸钠溶液中滴加少量盐酸,只生成碳酸氢钠:CO32-+H+=HCO3-,故D错误;
故选A。

 优等生题库系列答案
优等生题库系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:
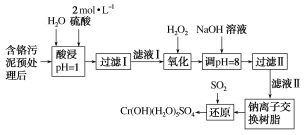
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
③Cr(OH)(H2O)5SO4是难溶物。
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ | |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480 mL2mol·L-1的硫酸,需要量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为___(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:__。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是___(填编号),滴定终点的现象是___。
A.NaCl B.K2CrO4 C.KI D.NaCN