题目内容
【题目】实验室中通常加热无水乙醇与浓硫酸的混合物的方法制取乙烯,在具体的化学实验中常因加热的温度过高导致副反应发生而使乙烯气体中混有二氧化硫气体,有人设计下列实验以确认乙烯气体中混有二氧化硫气体。请回答下列问题:
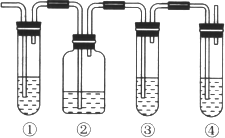
(1) 图中①和④的容器内盛放的化学试剂分别是(填写代号)
①_____________________、④_________________________。
A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________________________________。
(3)使用装置②的目的是______________________;使用装置③的目的是__________________。
(4)确认乙烯气体存在的现象是_____________________________________________________。
(5)确认乙烯气体的存在还可用溴水,请写出乙烯与溴水反应的方程式_________________;其反应类为______________________________________。
【答案】A D 装置①中的品红溶液褪色 除去二氧化硫 检验二氧化硫是否除干净 装置③中的品红溶液不褪色,装置④中的酸性高锰酸钾溶液褪色 CH2=CH2+Br2→CH2BrCH2Br 加成反应
【解析】
二氧化硫为酸性氧化物,可与碱反应,可使品红溶液褪色,具有还原性,可与酸性高锰酸钾溶液发生氧化还原反应,而乙烯含有碳碳双键,也能与酸性高锰酸钾溶液发生氧化还原反应,所以应该先检验二氧化硫,然后检验乙烯,结合装置图和问题分析解答。
(1)装置①中盛放品红溶液,用来检验二氧化硫,然后将气体通入盛有氢氧化钠溶液的洗气瓶中除去二氧化硫,再通入品红溶液检验二氧化硫是否除尽,最后通入酸性高锰酸钾溶液检验乙烯,则装置④中盛放酸性高锰酸钾溶液。答案选A、D;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,则能说明二氧化硫气体存在的现象是装置①中的品红溶液褪色。
(3)根据以上分析可知使用装置②的目的是除去二氧化硫,避免干扰乙烯的检验;使用装置③的目的是检验二氧化硫是否除干净,防止干扰乙烯的性质检验。
(4)根据以上分析可知确认乙烯气体存在的现象是装置③中的品红溶液不褪色,装置④中的酸性高锰酸钾溶液褪色。
(5)乙烯含有碳碳双键,与溴水发生加成反应,反应的方程式为CH2=CH2+Br2→CH2BrCH2Br。

 名校课堂系列答案
名校课堂系列答案【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
2min末浓度/mol/L | 0.08 | a | b |
平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20% B. t℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 D. 前2min内,用Y的变化最表示的平均反应速率v(Y)=0.03mol/(L·min)
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气。(实验记录的体积为累计值,已换算成标准状况):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___,原因是___。
(2)哪一段时段的反应速率最小___,原因是___。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液D.Na2CO3溶液
你认为可行的是(填编号)___。