题目内容
为研究和开发天然食用色素。某研究小组取等量相同品种的红枣,采用溶剂提取红枣中部分红色素,用紫外光谱仪测定不同温度下提取液的吸光度,实验结果见右图。已知吸光度越大,红色素含量越高。下列分析较合理的是
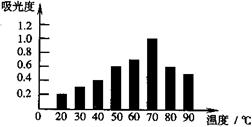

| A.20℃时,红枣中红色素含量最低 | |
| B.吸光度越大,红枣中红色素含量越高 | C.红色素可能在较高温度下不稳定 |
| D.温度越高,提取液中红色素含量越高 |
C
略

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下: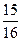 ,则N2的转化率
,则N2的转化率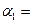 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则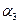
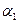 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) 
 CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
 压强/Mpa
压强/Mpa
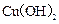 能使溶液恢复成原来浓度
能使溶液恢复成原来浓度