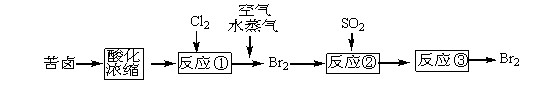
题目内容
(15分)[化学与技术]硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 。
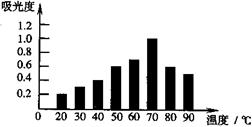
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N2 82%);
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度_______ ℃,压强 ___________MPa。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量? (填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用 吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 ________(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式_______________________________________。
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N2 82%);
 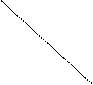 压强/Mpa 压强/Mpa转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(3)选择适宜的催化剂,是否可以提高SO2的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量? (填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用 吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
| A.保护环境。防止空气污染 | B.充分利用热量,降低生产成本 |
| C.升高温度,提高SO2的转化率 | D.防止催化剂中毒 |
(1)生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化
(2)400~500,0.1
(3)否,否
(4)98%硫酸
(5)B
(6)石灰水
(2)400~500,0.1
(3)否,否
(4)98%硫酸
(5)B
(6)石灰水
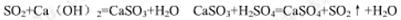
略

练习册系列答案
相关题目
 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题: H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K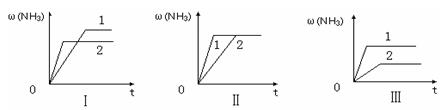
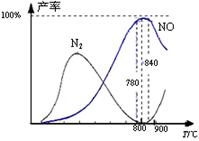
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)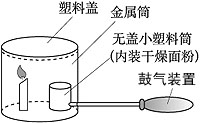
 式)。
式)。