题目内容
化学反应N2+3H2 2NH3的能量变化下图所示,该反应的热化学方程式是 ( )
2NH3的能量变化下图所示,该反应的热化学方程式是 ( )

 2NH3的能量变化下图所示,该反应的热化学方程式是 ( )
2NH3的能量变化下图所示,该反应的热化学方程式是 ( )
A.N2(g)+3H2(g)  2NH3(1);△H=2(a-b-c)kJ·mol-1 2NH3(1);△H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g);△H=-2(b-a)kJ·mol-1 2NH3(g);△H=-2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+ H2(g) H2(g)  NH3(1);△H=(b+c-a)kJ·mol-1 NH3(1);△H=(b+c-a)kJ·mol-1 |
D. N2(g)+ N2(g)+ H2(g) H2(g)  NH3(g);△H=(a+b)kJ·mol-1 NH3(g);△H=(a+b)kJ·mol-1 |
AB
试题分析:根据图像可知,反应物的总能量高于反应物的总能量,所以该反应是放热反应。由图像可知,每生成1mol氨气放热是(b-a)kJ。而生成1mol液态氨气放热则是(b+c-a)kJ,所以答案选AB。
点评:该题容易漏选A或错选C。这是由于忽略了反应热△H是有符号而引起的,即放热反应中△H<0,吸热反应中△H>0。

练习册系列答案
相关题目

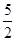 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1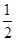 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1