题目内容
(12分)Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
Ⅱ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(1)燃料充分燃烧,利用率高 (2)② (3)C
(4)CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.0kJ·mol-1
(4)CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.0kJ·mol-1
试题分析:I(1)途径b是将煤先气化再燃烧,这样做的优点是燃料充分燃烧,利用率高。(2)反应①③④是放热反应,反应②是吸热反应,所以选②。(3)根据盖斯定律:定压定容条件下,任意一个反应其总反应的热效应只与反应的始态和终态有关而与反应的路程无关。两个途径产生的热量理论上是相同的。
II反应CH4(g)+2H2O(g)=CO2(g)+4H2(g),是由反应①CH4(g)+H2O(g)=CO(g)+3H2(g)乘以2减去反应②CH4(g)+CO2(g)=2CO(g)+2H2(g)得到的,所以反应热为ΔH=206.2kJ/mol×2-247.4kJ/mol=165kJ/mol。则热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.0kJ·mol-1。
点评:这类反应热综合试题是高考中的热点考题,主要考查学生的分析问题,解决问题的能力。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
 CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1 HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)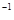 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定 (aq))+OH
(aq))+OH (aq))=H
(aq))=H O(l)△H=-57.3 kJ·mol
O(l)△H=-57.3 kJ·mol 的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ

 2NH3的能量变化下图所示,该反应的热化学方程式是 ( )
2NH3的能量变化下图所示,该反应的热化学方程式是 ( )
 2NH3(1);△H=2(a-b-c)kJ·mol-1
2NH3(1);△H=2(a-b-c)kJ·mol-1 N2(g)+
N2(g)+ H2(g)
H2(g)  O2(g)=H2O(1)△H = ―285.8kJ/mol
O2(g)=H2O(1)△H = ―285.8kJ/mol =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·