��Ŀ����
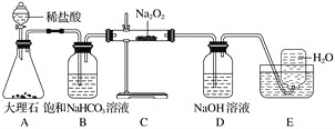
����Ŀ����֪ij��ȼ�Ϻ���̼���⡢������Ԫ�أ�Ϊ�˲ⶨ����ȼ����̼��������Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������O2��ȼ�գ���������������ȫ��ͨ��ͼʾװ�ã��õ�������е�ʵ�����ݣ�������������ȫ�����գ���
ʵ��ǰ | ʵ��� | |
�������+U�ιܣ������� | 101.1g | 102.9g |
������ʯ��ˮ+���ƿ�������� | 312.0g | 314.2g |
����ʵ��������գ�
��1��ʵ����Ϻ���������ˮ������Ϊg��������ƿ������һ�����Σ�������Ϊg��
��2�����ɵ�ˮ����Ԫ�ص�����Ϊg��
��3�����ɵ�CO2��̼Ԫ�ص�����Ϊg��
��4����ȼ����̼����Ԫ��������Ϊ ��
���𰸡�
��1��1.8��5
��2��0.2
��3��0.6
��4��3��1
���������⣺��1����Ϊ��ȼ�Ϻ�C��H��O����Ԫ�أ���ȼ�ղ���ΪCO2��H2O���������֪U�ι����ӵ�����Ϊ����ˮ��������102.9g��101.1g=1.8g��
���ƿ���ӵ�����Ϊ���ɵ�CO2������314.2g��312.0g=2.2g��CO2�����ʵ���= ![]() =0.05mol�����ƿ�����ɵ�����ΪCaCO3 �� ����Cԭ���غ��֪����CaCO3 0.05mol��������Ϊ0.05mol��100g/mol=5g�����Դ��ǣ�1.8��5����2��ˮ�к�HԪ������Ϊ1.8��
=0.05mol�����ƿ�����ɵ�����ΪCaCO3 �� ����Cԭ���غ��֪����CaCO3 0.05mol��������Ϊ0.05mol��100g/mol=5g�����Դ��ǣ�1.8��5����2��ˮ�к�HԪ������Ϊ1.8�� ![]() =0.2g�����Դ��ǣ�0.2����3�����ɵ�0.05mol CO2 �� ��CԪ������Ϊ0.05mol��12g/mol=0.6g�����Դ��ǣ�0.6����4������C��HԪ���غ㣬��ȼ����m��C����m��H��=0.6g��0.3g=3��1�����Դ��ǣ�3��1��
=0.2g�����Դ��ǣ�0.2����3�����ɵ�0.05mol CO2 �� ��CԪ������Ϊ0.05mol��12g/mol=0.6g�����Դ��ǣ�0.6����4������C��HԪ���غ㣬��ȼ����m��C����m��H��=0.6g��0.3g=3��1�����Դ��ǣ�3��1��