题目内容
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为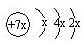 ,b与c形成化合物的电子式
,b与c形成化合物的电子式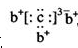 为下列比较中正确的是( )
为下列比较中正确的是( )
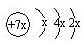 ,b与c形成化合物的电子式
,b与c形成化合物的电子式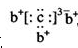 为下列比较中正确的是( )
为下列比较中正确的是( )| A.原子半径:a>c>d>b | B.电负性:a>b>d>c |
| C.最高价含氧酸的酸性:c>d>a | D.第一电离能:d>a>b>c |
C
由a的原子结构示意图可知,在短周期元素中,只有x=2时符合要求,即a为硅元素,且b、d均为第三周期元素;
由b与c形成化合物的电子式可看出,b元素可形成+1价阳离子,即钠元素;而c可形成—3价阴离子,可知为第VA族元素,它只能为第二周期元素N,进而可知d为磷元素
A:电子层数越大,半径越大,同周期自左向右半径逐渐减小,故原子半径b元素钠最大,不正确
B:非金属性越强,电负性越大,即c元素的电负性最大,排除
C:非金属性越强,最高价含氧酸的酸性越强,正确
D:金属性越强,第一电离能越小,即b元素钠最小,排除
答案为C
由b与c形成化合物的电子式可看出,b元素可形成+1价阳离子,即钠元素;而c可形成—3价阴离子,可知为第VA族元素,它只能为第二周期元素N,进而可知d为磷元素
A:电子层数越大,半径越大,同周期自左向右半径逐渐减小,故原子半径b元素钠最大,不正确
B:非金属性越强,电负性越大,即c元素的电负性最大,排除
C:非金属性越强,最高价含氧酸的酸性越强,正确
D:金属性越强,第一电离能越小,即b元素钠最小,排除
答案为C

练习册系列答案
相关题目
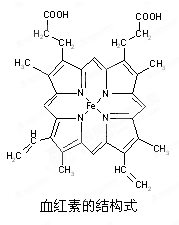
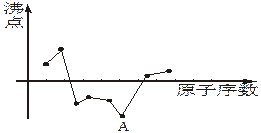
 化性;系列③物质对应水溶液除c外其它均是强酸
化性;系列③物质对应水溶液除c外其它均是强酸