题目内容
(7分)短周期元素A、B、C、D,其离子半径逐渐增大,它们的原子中核外都有一个未成对电子。已知A和D处于同一周期,0.2摩尔A单质可以从D的氢化物的水溶液中置换出6.72 L氢气(标准状况),试回答:
(1) A、B、C、D元素分别是A: ,B: ,C: ,D: 。
(2)比较C和D的氢化物(用分子式表示):
稳定性 > ,水溶液的酸性 >
(3)用电子式表示化合物BD的形成过程
(1) A、B、C、D元素分别是A: ,B: ,C: ,D: 。
(2)比较C和D的氢化物(用分子式表示):
稳定性 > ,水溶液的酸性 >
(3)用电子式表示化合物BD的形成过程
(1)Al Na F Cl
HF>HCl HCl>HF (3)略
HF>HCl HCl>HF (3)略
(1)6.72 L氢气(标准状况)的物质的量为0.3mol,即0.2摩尔A与D的氢化物的水溶液反应失去0.6mol电子,得A元素的化合价为+3价,所以可知A元素为AL元素。又因为A、B、C、D原子中核外都有一个未成对电子,B为Na元素,C为F元素,D为CL元素。
(2)C和D的氢化物分别为:HF、HCL,由于CL的非金属性小于F的非金属性,所以其稳定性关系为:HF>HCl;HF酸为弱酸HCL酸为强酸,所以水溶液的酸性强弱为:HCl>HF
(3)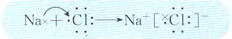
(2)C和D的氢化物分别为:HF、HCL,由于CL的非金属性小于F的非金属性,所以其稳定性关系为:HF>HCl;HF酸为弱酸HCL酸为强酸,所以水溶液的酸性强弱为:HCl>HF
(3)
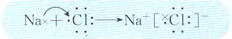

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
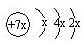 ,b与c形成化合物的电子式
,b与c形成化合物的电子式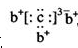 为下列比较中正确的是( )
为下列比较中正确的是( )