题目内容
15.周期表里的四种短周期主族元素的相对位置如表所示.已知它们的原子序数总和为46,则| m | n | ||
| x | y |
(2)用电子排布式表示x原子的价电子结构为3s23p4;
(3)m与y所形成化合物的化学式为CCl4(填元素符号,下同);
(4)x与y相比,电负性较大的是Cl,理由是Cl原子的核电荷数比S的大,原子半径比S的小,故Cl的原子核吸引电子的能力比硫的强.
分析 由四种短周期主族元素在周期表中位置,可知m、n处于第二周期,x、y处于第三周期,设n的原子序数为a,则m原子序数为a-1,x原子序数为a+9,y的原子序数为a+10,它们的原子序数总和为46,则a-1+a+a+9+a+10=46,解得a=7,则n为N元素、m为C元素、x为S元素、y为Cl.
解答 解:由四种短周期主族元素在周期表中位置,可知m、n处于第二周期,x、y处于第三周期,设n的原子序数为a,则m原子序数为a-1,x原子序数为a+9,y的原子序数为a+10,它们的原子序数总和为46,则a-1+a+a+9+a+10=46,解得a=7,则n为N元素、m为C元素、x为S元素、y为Cl.
(1)由上述分析可知,元素n的原子序数为7,故答案为:7;
(2)x为S元素,原子的价电子结构为3s23p4,故答案为:3s23p4;
(3)m与y所形成化合物的化学式为CCl4等,故答案为:CCl4;
(4)Cl原子的核电荷数比S的大,原子半径比S的小,故Cl的原子核吸引电子的能力比硫的强,故Cl的电负性较大,
故答案为:Cl;Cl原子的核电荷数比S的大,原子半径比S的小,故Cl的原子核吸引电子的能力比硫的强.
点评 本题考查结构性质位置关系应用,注意从结构上理解电负性强弱,注意理解同主族元素原子序数关系.

练习册系列答案
相关题目
6.下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定,不符合上述要求的是( )
| A. | 苯、甲苯 | B. | 乙炔、苯乙烯 | C. | 甲醛、甲酸甲酯 | D. | 乙烯、环己烷 |
3.对下列结构的多肽说法不正确的是( )


| A. | 该多肽水解产物中无 | B. | 该多肽是一个五肽 | ||
| C. | 该多肽具有两性 | D. | 该多肽分子中有四个肽键 |
10.下列有机物系统命名正确的是( )
| A. | 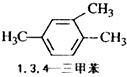 | B. | 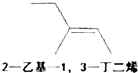 | C. | 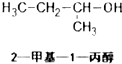 | D. |  |
7.下列说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | ⅠA族和ⅦA族元素原子化合时,一定形成离子键 | |
| C. | 由非金属元素形成的化合物一定是共价化合物 | |
| D. | 活泼金属与活泼非金属化合时,能形成离子键 |
4.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用溴水可区分己烷和3--己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用新制的氢氧化铜悬浊液可区分甲酸甲酯和乙醛 |
5.下列仪器使用不当的是( )
| A. | 试管可作为反应容器 | |
| B. | 量筒用于量取一定液体药品 | |
| C. | 胶头滴管用过应立即清洗滴瓶中的滴管也是如此 | |
| D. | 烧杯常用作配制溶液和较大试剂的反应容器 |
 A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去).
A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去).