题目内容
20.以下是元素周期表如图1的一部分: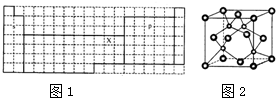
(1)表中区域名称s、p…确定的依据是根据构造原理最后填入电子的能级的符号.
(2)已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布为1s22s22p63s23p63d34s2,B在元素周期表中的位置是第四周期第VIA族.
(3)上表中元素X的一种氢化物的晶体结构如图2所示,写出该化合物在氯气中燃烧的化学方程式:2CuCl+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl.除X外,第4周期中最外层只有一个电子的还有钾、铬(写元素名称).
(4)在上表中画出金属和非金属的分界线.
分析 (1)根据构造原理最后填入电子的能级的符号将元素周期表分为s、p…等区域;
(2)A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A原子各层电子数依次为2、8、11、2,B原子各层电子数依次为2、8、18、6;
(3)X为Cu元素,由晶胞晶胞可知,晶胞中小球有4个,大球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则该化合物为CuH,在氯气中燃烧生成CuCl2与HCl;除外Cu,第四周期中最外层只有一个电子的核外电子排布为[Ar]4s1[Ar]3d54s1;
(4)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素.
解答 解:(1)根据构造原理最后填入电子的能级的符号将元素周期表分为s、p…等区域,
故答案为:根据构造原理最后填入电子的能级的符号;
(2)A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A原子各层电子数依次为2、8、11、2,B原子各层电子数依次为2、8、18、6,A原子核外电子排布式为1s22s22p63s23p63d34s2,B处于周期表中第四周期第VIA族,
故答案为:1s22s22p63s23p63d34s2;第四周期第VIA族;
(3)X为Cu元素,由晶胞晶胞可知,晶胞中小球有4个,大球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则该化合物为CuH,在氯气中燃烧生成CuCl2与HCl,反应方程式为:2CuCl+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl;除外Cu,第四周期中最外层只有一个电子的核外电子排布为[Ar]4s1、[Ar]3d54s1,分别为:钾与铬,
故答案为:2CuCl+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl;钾、铬;
(4)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素,画出金属和非金属的分界线为: ,
,
故答案为: .
.
点评 本题考查元素周期表、核外电子排布、晶胞计算等,有利于基础知识的巩固,难度不大.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案| A. | “酸可除锈”、“纯碱溶液可去油污”都发生了化学变化 | |
| B. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 滴定管以及容量瓶在使用前需检查是否漏水 |
| A | B | C | D | |
| 正极 | Fe | Fe | C | Cu |
| 负极 | Cu | Zn | Fe | Fe |
| 电解质溶液 | HNO3 | H2SO4 | HCl | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
| m | n | ||
| x | y |
(2)用电子排布式表示x原子的价电子结构为3s23p4;
(3)m与y所形成化合物的化学式为CCl4(填元素符号,下同);
(4)x与y相比,电负性较大的是Cl,理由是Cl原子的核电荷数比S的大,原子半径比S的小,故Cl的原子核吸引电子的能力比硫的强.
| A. | 维生素C具有还原性,在人体内起抗氧化作用. | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 | |
| C. | 日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 | |
| D. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 |
| 元素性质[] | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-) (均用实际的元素符号表示).
比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bcd(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的PH值来鉴别.
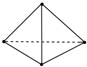 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )| A. | +882 kJ•mol-1 | B. | +441 kJ•mol-1 | C. | -882 kJ•mol-1 | D. | -441 kJ•mol-1 |
 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题: ;
;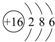 .
.