题目内容
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
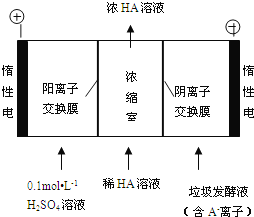
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
【答案】第四周期第ⅤA族2H3AsO3+3S2-+6H+═As2S3↓+6H2O4H2O+2CN-+O2═2HCO3-+2NH32H2O-4e-═4H++O2↑阳极H2O放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-从阴极通过阴离子交换膜进入浓缩室,H++A-═HA,乳酸浓度增大6.72
【解析】
(1)①砷原子电子层数=周期数=4,最外层电子数=族序数=5,所以砷位于第四周期第ⅤA族;因此本题答案是:第四周期第ⅤA族。
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷,据此得到反应的离子方程式为:2H3AsO3+3S2-+6H+═As2S3↓+6H2O;因此,本题答案是:2H3AsO3+3S2-+6H+═As2S3↓+6H2O。
(2)CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为:4H2O+2CN-+O2═2HCO3-+2NH3;因此,本题答案是:4H2O+2CN-+O2═2HCO3-+2NH3。
(3) ①阳极上是氢氧根离子失电子发生氧化反应,电极反应式为:2H2O-4e-═4H++O2↑ ;因此本题答案是:2H2O-4e-═4H++O2↑。
②在电解池的阳极上是氢氧根放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即 A-通过阴离子交换膜从阴极进入浓缩室,发生反应:H++A-═HA,使乳酸浓度增大;综上所述,本题答案是:阳极H2O放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-从阴极通过阴离子交换膜进入浓缩室,H++A-═HA,乳酸浓度增大。
③在阳极上发生电极反应:4OH—-4e-=2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA—H+--1/2H2,据差值法,乳酸的浓度变化量是(145-10)/90=1.5mol/L,即生成HA的物质的量是1.5×0.4=0.6mol,即产生氢气0.3mol,即0.3×22.4=6.72L;综上所述,本题答案是:6.72L。