题目内容
【题目】氮化铝(AlN)是一种新型的无机非金属材料,工业上制备原理如下:Al2O3+N2+3C![]() 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
【方案1】有人想用下列A、B两个装置中的一种(在通风橱内进行)。只需进行简单而又必要的数据测定,用差量法就可测定样品中A1N的质量分数,较合理的装置是:___________(填代号)。

【方案2】取一定量(m1)的样品,用以下装置测定样品中A1N的纯度(夹持装置己略去)。

(1)上图C装置中球形干燥管的作用是___________;
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性:再加入实验药品,接下来关闭K1打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间。
请回答:I、需测定___________(填A、B、C)装置反应前后的质量变化。Ⅱ、通入氮气的目的是____________。
【方案3】按以下步骤测定样品中A1N的含量:
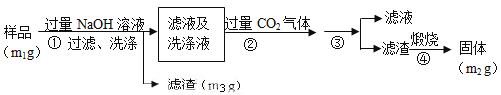
(1)步骤②生成沉淀的离子方程式为___________;
(2)步骤③的操作是___________,A1N的纯度是___________(用m1、m2、m3表示)。
【答案】3:2;
【方案1】B
【方案2】(1)防止倒吸;(2)C;把装置中残留的氨气全部赶入C装置;
【方案3】(1)CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;(2)过滤、洗涤;![]() ×100%
×100%
【解析】
试题分析:(1)氮化铝(AlN)制备:Al2O3+N2+3C![]() 2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂被氧化为一氧化碳,所以氧化产物与还原产物的物质的量之比为3:2;故答案为:3:2;
2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂被氧化为一氧化碳,所以氧化产物与还原产物的物质的量之比为3:2;故答案为:3:2;
【方案1】装置B较合理,这是通过反应前后总质量减少来测定AlN的质量分数.这里的干燥管作用是吸收被NH3带出来的水蒸气(反应放热,更容易使产生的水蒸气被NH3带走),若用A,则NH3被吸收,反应前后几无质量差,故答案为:B;
【方案2】(1)上图C装置中球形干燥管可以防止倒吸,故答案为:防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体,打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,故答案为:C;把装置中残留的氨气全部赶入C装置;
【方案3】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(1)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(2)根据题意,杂质不与氢氧化钠溶液反应,步骤③是过滤洗涤得到氢氧化铝沉淀,煅烧得到氧化铝,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,Al2O3物质的量=![]() =
=![]() mol,依据铝元素守恒得到样品中铝元素物质的量=n(AlN)=
mol,依据铝元素守恒得到样品中铝元素物质的量=n(AlN)=![]() mol×2=
mol×2=![]() mol,A1N的质量=
mol,A1N的质量=![]() mol×41g/mol=
mol×41g/mol=![]() g,纯度=
g,纯度=![]() g/m1g=
g/m1g=![]() ×100%,故答案为:过滤、洗涤;
×100%,故答案为:过滤、洗涤;![]() ×100%
×100%