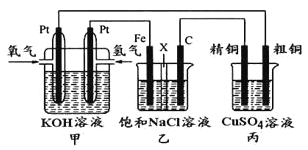
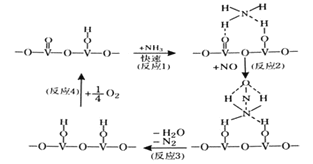
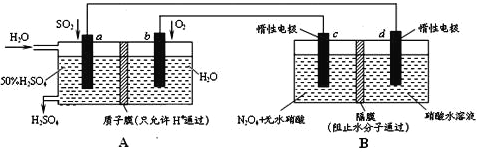
题目内容
【题目】以NA代表阿伏加德罗常数,且已知C2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol,则下列说法中正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol,则下列说法中正确的是( )
A.当有20NA个电子转移时,热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2600 kJ/mol
B.当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
C.若生成NA个水蒸气分子的焓变为ΔH',则ΔH'<ΔH
D.题给反应为吸热反应
【答案】A
【解析】
A、当有20NA个电子转移时,转移电子物质的量为20NA,反应中氧元素化合价由0价降低为-2价,故参加反应的氧气的物质的量为![]() ,根据热化学方程式中
,根据热化学方程式中![]() 氧气参加反应放热
氧气参加反应放热![]() ,所以
,所以![]() 氧气反应放热2600kJ,热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol,故A正确;
氧气反应放热2600kJ,热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol,故A正确;
B、1个![]() 分子中含有4个碳氧共用电子对,有
分子中含有4个碳氧共用电子对,有![]() 个碳氧共用电子对,说明有
个碳氧共用电子对,说明有![]() 生成,根据热化学方程式中
生成,根据热化学方程式中![]() 二氧化碳参加反应放热
二氧化碳参加反应放热![]() ,所以
,所以![]() 二氧化碳反应放热650 kJ,故B错误;
二氧化碳反应放热650 kJ,故B错误;
C、气态水的能量比液态水的能量高,故生成气态水放出的热量少,但是ΔH为负值,所以反应热ΔH'偏大,所以ΔH'>ΔH,故C错误;
D、该反应为放热反应,故D错误。
故答案选A。

【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)