题目内容
【题目】已知:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol;
O2(g)═H2O(l)△H=﹣285.8kJ/mol;
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol;
H2O(l)═H2O(g)△H=+44.0kJ/mol.
(1)写出丙烷燃烧生成CO2和气态水的热化学方程式:
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kj,则混合气体中H2和C3H8的体积比为多少?
【答案】
(1)解:已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=﹣2220.0kJ/mol
②H2O(1)=H2O(g);△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol,
答:丙烷燃烧生成CO2和气态水的热化学方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol
(2)解:由热化学方程式可知,氢气的燃烧热为285.8kJ/mol,丙烷的燃烧热为2220.0kJ/mol,H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5KJ,则混合气体中H2和C3H8的平均燃烧热为 ![]() =1252.5kJ/mol,根据十字交叉法计算H2和C3H8的体积比:
=1252.5kJ/mol,根据十字交叉法计算H2和C3H8的体积比: 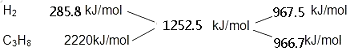
故H2和C3H8的体积比为967.5kJ/mol:966.7kJ/mol=1:1.
答:混合气体中H2和C3H8的体积比为1:1
【解析】(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;(2)计算H2和C3H8的平均燃烧热,根据十字交叉法计算H2和C3H8的体积比即可.

【题目】氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4 , 含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1: 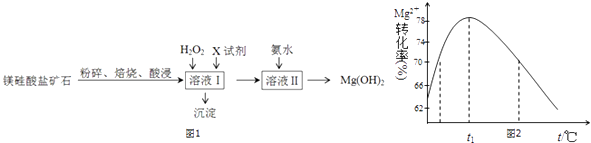
已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)对矿石焙烧的目的是 .
(2)加入H2O2溶液反应的离子方程式是 .
(3)向溶液Ⅰ中加入的X可以是 , 作用是 .
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示: ①溶液Ⅱ中发生反应的离子方程式是 .
②t1前Mg2+转化率增大的原因是;
t1后Mg2+转化率下降的原因是(用化学方程式表示) .