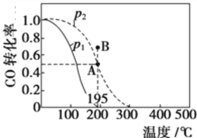
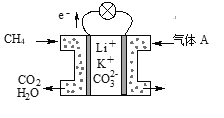
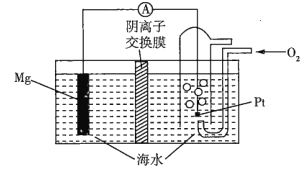
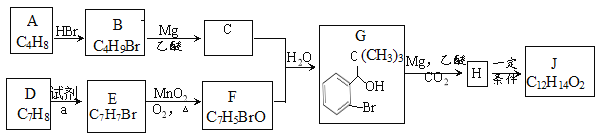
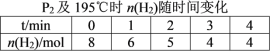题目内容
【题目】书写化学方程式并注明反应类型(有机物写结构简式)
①实验室制取乙炔气体:________(________)
②甲苯制备TNT:________(________)
【答案】CaC2+2H2O→Ca(OH)2+CH≡CH↑ 水解反应 ![]() +3HNO3
+3HNO3![]()
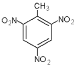 +3H2O 取代反应
+3H2O 取代反应
【解析】
实验室制乙炔,常用电石与饱和食盐水反应,用食盐水代替水,可减少实验过程中泡沫的产生并减缓反应速率;由甲苯制TNT,就是将甲苯与混酸在加热条件下反应,生成三硝基甲苯和水。
①实验室制取乙炔气体,使用电石(CaC2)与水反应,生成Ca(OH)2和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;反应的类型是水解反应。
②甲苯与浓硝酸在浓硫酸、加热条件下发生反应,生成TNT(三硝基甲苯),反应的化学方程式为:![]() +3HNO3
+3HNO3![]()
 +3H2O,由于反应过程中发生的是-NO2取代苯环上H原子的反应,所以属于取代反应。
+3H2O,由于反应过程中发生的是-NO2取代苯环上H原子的反应,所以属于取代反应。
答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;水解反应;![]() +3HNO3
+3HNO3![]()
 +3H2O;取代反应。
+3H2O;取代反应。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】A、B、C、D、E、F、G是前四周期元素,原子序数依次增大,根据表中提供的有关信息,回答问题:
元素 | 相关信息 |
A | 所有单质中密度最小 |
B | 形成化合物种类最多的元素 |
D | 基态原子中只有3个能级,有2个未成对电子 |
E | 短周期中原子半径最大 |
F | 第三周期中电负性最大的元素 |
G | 最外层只有一个电子,内层填满电子 |
(1)E元素在周期表中的位置是______,F元素原子最外层电子排布式为______,BD2的立体构型为______。
(2)由D、E、F三种元素形成的一种常见物质的水溶液显碱性,用离子方程式表示其显碱性的原因:______。
(3)氢化物稳定性:B______D;最高价氧化物对应的水化物酸性:C______F。(填“<”或“>”)
(4)每个B2A4分子中含有______个σ键,______个π键。