��Ŀ����
��ѧ��Ӧԭ���ڹ�ҵ�����о���ʮ����Ҫ�����塣
��1���ϳɰ��õ������ж�����ȡ����������д����C�Ʊ�ˮú���Ļ�ѧ��Ӧ����ʽ ������������Ȼ����������ȡ������CH4��H2O(g) ���´���CO��3H2���Ƚ��������ַ���ת��6mol����ʱ��C��CH4������֮���� ��
��2����ҵ����������NH3��g����CO2��g������������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�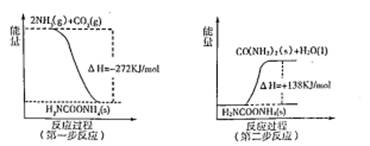
��NH3��g����CO2��g����Ӧ�������ص��Ȼ�ѧ����ʽΪ ��
��3����֪��ӦFe��s��+CO2��g����FeO��s��+CO��g�� ��H��akJ/mol������ڲ�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ��K���¶ȵı仯���£�
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK= ��a 0���>������<������������500��2L�ܱ������н��з�Ӧ��Fe��CO2����ʼ����Ϊ4 mol����5min��ﵽƽ��ʱCO2��ת����Ϊ ������CO��ƽ������v��CO��Ϊ ��
��700�淴Ӧ�ﵽƽ���Ҫʹ��ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ�� ������ĸ����
| A����С��Ӧ���ݻ� | B������Fe�����ʵ��� |
| C�������¶ȵ�900�� | D��ʹ�ú��ʵĴ��� |
��15�֣����һ��1�֣�����ÿ��2�֣���1��C��H2O(g) CO��H2��9:4
��2��2NH3��g��+CO2��g����H2O��l��+CO(NH2)2��s�� ��H����134kJ/mol
��3���٣�����50%��0.2mol/(L��min) ��C
���������������1��������̼��ˮ������Ӧ����������CO����Ӧ�Ļ�ѧ����ʽ��C��H2O(g) CO��H2����Ӧ��̼�Ļ��ϼ۴�0�����ߵ���2�ۣ�ת��2�����ӡ����ת��6mol����ʱ������̼���ʵ������ǣ�12g/mol��3mol��36g���ڷ�ӦCH4��H2O(g) ���´���CO��3H2��̼�Ļ��ϼ۴ӣ�4�����ߵ���2�ۣ�ת��6�����ӡ����ת��6mol����ʱ���ļ����������16g�������������ַ���ת��6mol����ʱ��C��CH4������֮����36:16��9:4��
��2������ͼ���֪����һ����Ӧ�з�Ӧ��������������������������������Ƿ��ȷ�Ӧ����Ӧ���Ȼ�ѧ����ʽ��2NH3��g��+CO2��g����H2NCOONH4��l����������泥� ��H1����272KJ/mol���ڶ�����Ӧ�У���Ӧ������������������������������˷�Ӧ�����ȷ�Ӧ����Ӧ�Ļ�ѧ����ʽ��H2NCOONH4��l����H2O��l��+ CO(NH2)2��s�� ��H2����138KJ/mol�����ݸ�˹���ɿ�֪������������Ӽ��õ�NH3��g����CO2��g����Ӧ�������ص��Ȼ�ѧ����ʽ����Ϊ2NH3��g��+CO2��g����H2O��l��+ CO(NH2)2��s�� ��H����272KJ/mol��138KJ/mol����134kJ/mol��
��3���ٻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ�ӦFe��s��+CO2��g����FeO��s��+CO��g����֪���÷�Ӧ��ƽ�ⳣ��K�����ɱ������ݿ�֪�����ڷ�Ӧ�٣��¶�Խ��ƽ�ⳣ��Խ��˵�������¶�ƽ��������Ӧ�����ƶ������������¶�ƽ�������ȷ�Ӧ������У���a��0����ƽ��ʱ�μӷ�Ӧ�Ķ�����̼�����ʵ���Ũ��Ϊxmol����
Fe��s��+CO2��g����FeO��s��+CO��g��
��ʼŨ�ȣ�mol/L�� 2 0
ת������mol/L�� x x
ƽ������mol/L�� 2��x x
���Ը���ƽ�ⳣ���ı���ʽ��֪��1�����x��1�����Զ�����̼��ת����Ϊ��100%��50%������CO��ʾ��ƽ������v��CO������0.2mol/��L?min����
��A����Ӧǰ��������䣬��С��Ӧ���ݻ���ѹǿ����ѧƽ�ⲻ�ƶ�����A����
B�����ǹ��壬����Fe�����ʵ�������������ѧƽ����ƶ�����B����
C������Ӧ�����ȷ�Ӧ�������¶ȵ�900�棬��ѧƽ�������ƶ�����C��ȷ��
D������ֻ�ܸı䷴Ӧ���ʣ����ܸı�ƽ��״̬������ʹ�ú��ʵĴ�������������ѧƽ����ƶ�����D����ѡC��
���㣺����������ԭ��Ӧ����ʽ����д�ͼ��㣻�Ȼ�ѧ����ʽ����д����ѧƽ�ⳣ�����й�Ӧ�úͼ��㣻���������ƽ��״̬��Ӱ���

 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д���15�֣�
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ش�������״��йص����⣮
��1���״�������____���ӣ�����ԡ��Ǽ��ԡ�����
��2����ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO(g)+2H2(g) CH3OH(g)��H=-86.6kJ/mol����T��ʱ����һ������̶�Ϊ1L���ܱ������м���1mol CO��2mol H2������Ӧ�ﵽƽ��ʱ�������ڵ�ѹǿ�ǿ�ʼʱ��3/5��
CH3OH(g)��H=-86.6kJ/mol����T��ʱ����һ������̶�Ϊ1L���ܱ������м���1mol CO��2mol H2������Ӧ�ﵽƽ��ʱ�������ڵ�ѹǿ�ǿ�ʼʱ��3/5��
�ٴﵽƽ��ʱ��CO��ת����Ϊ ��
������ѡ�����жϸ÷�Ӧ�ﵽƽ��״̬�����ݵ���____ ��
A�� | B��CO���������ʵ���CH3OH���������� |
| C�������ڵ�ѹǿ���ֲ��� | D�����������ܶȱ��ֲ��� |
 ��3����֪�ڳ��³�ѹ�£�
��3����֪�ڳ��³�ѹ�£�
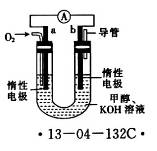
��4���ɼ״���������NaOH��Һ���ɵ������ֻ���أ���ʹ�ֻ�����ʹ��һ���²ų�һ�ε硣
�ٸõ�ظ����ĵ缫��ӦʽΪ____
�����Ըõ��Ϊ��Դ����ʯī���缫���200mL�����������ӵ���Һ��

���һ��ʱ��������ռ�����ͬ�������ͬ������������ʱ��������Һ����ı仯���缫������ܴ��ڵ��ܽ������������ռ�������������Ϊ ��
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
��1����CO2�뽹̿��������CO��CO�����������ȡ�
����֪��Fe2O3(s)��3C(ʯī)��2Fe(s)��3CO(g) ��H1�� +489.0 kJ/mol
C(ʯī)��CO2(g)��2CO(g) ��H2��+172.5 kJ/mol
��CO��ԭFe2O3���Ȼ�ѧ����ʽΪ ��
���Ȼ��٣�PdCl2����Һ����Ӧ���ڼ���������CO��PdCl2����ԭ�ɵ��ʣ���Ӧ�Ļ�ѧ����ʽΪ ��
��2��������ʯī�缫����KOH��Һ�У��������ֱ�ͨ��C3H8��O2���ɱ���ȼ�ϵ�ء�
�ٸ����缫��Ӧʽ�ǣ� ��
��ijͬѧ���ñ���ȼ�ϵ�������һ�ֵ�ⷨ��ȡFe(OH)2��ʵ��װ�ã�����ͼ��ʾ����ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ���� ������ţ�
A����Դ�е�aһ��Ϊ������bһ��Ϊ����
B��������NaCl��Һ��Ϊ���Һ
C��A��B���˶������������缫
D�����������ķ�Ӧ�ǣ�2H+��2e����H2��
��3������ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
�ٸ÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
��ʵ��2�У�ƽ�ⳣ��K�� ��
��ʵ��3��ʵ��2��ȣ��ı������������ ����һ��������ɣ���
��4����2.4g̼������������ȼ�գ���������ͨ��100mL 3.0mol/L������������Һ�У���ȫ���պ���Һ���������ӵ����ʵ���Ũ���ɴ�С��˳�� ��
Ϊ��СCO2�Ի�����Ӱ�죬���������ŷ�����ͬʱ��Ӧ��ǿ��CO2�������õ��о���
��1���ٰѺ��нϸ�Ũ��CO2�Ŀ���ͨ�뱥��K2CO3��Һ�����ڢٵ�����Һ��ͨ����ˮ�����õ���Ũ�ȵ�CO2���塣д�����з�Ӧ�Ļ�ѧ����ʽ__________________________��
��2���罫CO2��H2��1:3������Ȼ�ϡ�
���ʵ������ºϳ�ij����ˮ�������� ������ţ���
| A������ | B��ϩ�� | C��Ȳ�� | D������ͬϵ�� |
 CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
�ӷ�Ӧ��ʼ��ƽ�⣬v(H2)= ��������ת����= ����ʹƽ����ϵ��n(CH3OH)����Ĵ�ʩ��__________________________________________________��
��3���罫CO2��H2��1:4������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) ��H1="�D890.3" kJ/mol
H2(g) + 1/2O2(g)=H2O(l) ��H2=��285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ��____________________��
��4��ijͬѧ�ó������ⶨ���нϸ�Ũ��CO2�Ŀ�����CO2�ĺ����������һЩ������20����������±���
| �ܽ�ȣ�S��/g | �ܶȻ���Ksp�� | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9��10��9 | 2.6��10��9 |
��˵����KspԽС����ʾ��������ˮ��Һ��Խ�׳�����
����CO2����ʵ��Լ��� (�Ca(OH)2����Ba(OH)2��)��Һ��ʵ��ʱ����Ҫ�ⶨ��ҵ���������������ɱ�״�����⣬����Ҫ�ⶨ ��
��ȥ���ʺ��ˮú����Ҫ��H2��CO��������ĺϳɼ״���ԭ������
��1������ˮú�������������·�Ӧ����C(s)+CO2(g) 2CO(g) ��H1��
2CO(g) ��H1��
��CO(g)+H2O(g) H2(g)+CO2(g) ��H2����C(s)+H2O(g)
H2(g)+CO2(g) ��H2����C(s)+H2O(g) CO(g)+H2(g) ��H3��
CO(g)+H2(g) ��H3��
������Ӧ��H3���H1����H2֮��Ĺ�ϵΪ ��
��2����CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��2CH4(g)��3O2(g) 4CO(g)��4H2O(g) ��H=��1038kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ����
4CO(g)��4H2O(g) ��H=��1038kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ����
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
����������Ϣ������Ϊ��������Ӧ��ѡ������˴����� ���X����Y����Z������ѡ��������� ��
��3�����ڴ���У�������2���з�Ӧ���д�����������������·�Ӧ��������ϵ�����仯ʾ��ͼ�������б�Ҫ��ע��
��4���ϳ����ϳɼ״�����Ҫ��Ӧ�ǣ�2H2(g)+CO(g) CH3OH(g) ��H=��90.8kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160��
CH3OH(g) ��H=��90.8kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160��
���¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L��1�� | 0.20 | 0.10 | 0.40 |
�ٸ�ʱ�����ƽ����Ӧ����v(H2)= ��
�ڱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v(��) v (��)���������������������
��5�����������У��ϳ���Ҫ����ѭ������Ŀ���� ��
 N2(g)��CO2(g)ij�о�С��������ܱ���������һ�����Ļ���̿��NO�����£�T��C)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ������
N2(g)��CO2(g)ij�о�С��������ܱ���������һ�����Ļ���̿��NO�����£�T��C)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ������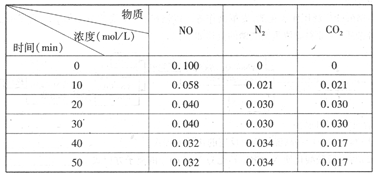
 N2��2CO2 ��H<0�о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʣ�Ϊ�˷ֱ���֤�¶ȡ������ıȱ�����Ի�ѧ�� Ӧ���ʵ�Ӱ����ɡ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ������±��С�
N2��2CO2 ��H<0�о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʣ�Ϊ�˷ֱ���֤�¶ȡ������ıȱ�����Ի�ѧ�� Ӧ���ʵ�Ӱ����ɡ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ������±��С�

 O2(g)= CO2(g)+2H2(g)����H2
O2(g)= CO2(g)+2H2(g)����H2 SO3(g) +NO(g)��
SO3(g) +NO(g)��
 A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A2(g)��B2(g)�ﵽƽ��״̬�ı�־��