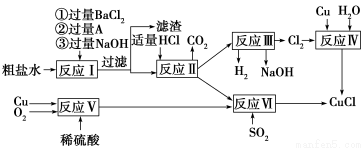
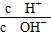题目内容
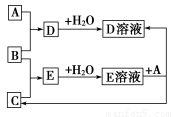
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
阳离子 | NH4+、Na+、Mg2+ |
阴离子 | OH-、NO3—、SO42— |
取等质量的三种化合物配制成相同体积的溶液,其溶质的物质的量浓度:c(甲)>c(乙)>c(丙)。
(1)甲是________,向AlCl3溶液中逐滴加入甲溶液,观察到的现象是________,对应的离子方程式为________。
(2)乙是______,设计实验确定乙的物质组成________(若乙已确定,则不填该空)。
(1)NaOH 先生成白色沉淀,继续滴加,白色沉淀消失 Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2—+2H2O
(2)(NH4)2SO4或NH4NO3 取乙溶液于小试管中,加入适量BaCl2溶液,若有白色沉淀析出,则乙是(NH4)2SO4,若无明显现象,则乙是NH4NO3
【解析】甲、乙、丙均是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙有两种组合(括号里数字表示相对分子质量),第一组:NaOH(40)、(NH4)2SO4(132)、Mg(NO3)2(148);第二组:NaOH(40)、NH4NO3(80)、MgSO4(120),根据溶质质量相等、溶液体积相等以及物质的量浓度大小关系判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲),则乙可能是硫酸铵或硝酸铵。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目